Развитие эндоваскулярных методов лечения позволяет достичь клинически значимых результатов в лечении стенозирующего атеросклероза. Чрескожная баллонная ангиопластика и эндопротезирование (стентирование) артерий позволяет достичь непосредственного успеха более чем в 95% случаев [1]. Однако, в разные сроки после вмешательства повторное сужение артерии (рестеноз) развивается в 10-50% случаев.
Баллонная ангиопластика реализуется двумя основными механизмами:
- Механическое растяжение стенки артерии. Поэтому после сдувания баллона, в большей или меньшей степени, происходит уменьшение просвета сосуда (recoil) в силу эластических свойств сосудистой стенки артерии и в ряде случаев эффект ангиопластики с течением времени теряется. Постановка металлического каркаса - стента внутри сосуда позволяет избежать эластического повторного сужения просвета сосуда, однако, неизбежно вызывает ответную реакцию на имплантацию инородного тела. За первичным повреждением следует пристеночный тромбоз, пролиферация и миграция клеточных элементов медии и интимы, эндотелизация поверхности стента [2]. Благодаря этому поверхность стента становиться гладкой и атромбогенной, однако, иногда подобная реакция избыточна и может привести к повторному сужению внутри стента – рестенозу. Проблема рестеноза может быть решена с помощью направленной фармакотерапии, при которой стент покрывают средствами антипролиферативного действия. Однако, и у такого подхода есть существенный потенциальный недостаток. Ингибирование процесса эндотелизации стента может привести к поздним тромбозам. Неясно насколько безвредно для организма выделение потенциально токсичных веществ. С этой точки зрения установка стента на временной основе (на 5-7 суток) весьма привлекательна. Во-первых, расширение просвета артерии может быть более эффективным, чем после баллонной ангиопластики, во-вторых, удаление стента могло бы стать наилучшей профилактикой рестеноза.
- Второй механизм реализации баллонной ангиопластики появление микротрещин, надрывов во внутреннем слое артерии, которая порой может приводить к окклюзирующей диссекции интимы. Это осложнение также требует имплантации стента. Стент на постоянной основе приходится имплантировать и при случайном повреждении интактной интимы. Использование временного стента в подобных случаях кажется более логичным.
Главной целью данного исследования являлось создание стента для временной имплантации и систему для его удаления. При этом решались следующие задачи: разработка методики и тактики имплантации и безопасного удаления стента; изучение ангиографических и морфологических характеристик артерии после имплантации и удаления временного стента; установление оптимальных сроков для удаления временного стента
Материалы и методы
В работе использован временный стент - модификация самораскрывающегося проволочного ZA-стента ( William COOK Europa A/S, Дания), с дополни-тельными ячейками – дужками для удаления (Рис. 1).

Рис. 1. Временные ЗА-стенты с дополнительными ячейками для захвата на дистальных концах стентов
Диаметр стентов 8 или 10 мм, длина 30, 40 и 60 мм. Диаметр доставляющей системы и системы для удаления 8 F. Для удаления используется захват из трех крючков.
Экспериментальное исследование проводилось на 13 домашних свиньях. После интубации трахеи и внутривенного наркоза животных переводили на полную искусственную вентиляцию легких. Под рентгеноскопией пунктировали бедренную артерию, проводили ангиографию. Стенты диаметром 8 и 10 мм, и длиной 40, 60 мм имплантировали в супраренальные, инфраренальные сегменты аорты. В подвздошные артерии имлантировали стенты диаметром 8 мм и длиной 30 и 40 мм. После этого ангиографическое исследование повторяли. У 4 животных проведены острые эксперименты, в которых отрабатывалась методика постановки и удаления стента. В данной группе стенты удалены сразу же после имплантации. 9 экспериментальных животных разделили на 3 группы. Стенты в этих группах удаляли на 2, 3 и 7 сутки после имплантации. Контрольное ангиографическое исследование проводилось до и сразу после удаления стента. Диаметр системы для доставки и удаления стентов 8F.
Сразу после удаления стентов животных вскрывали, стентированные сегменты артерий и аорты выделяли, фотографировали. После этого изучаемые сегменты фиксировали в растворе формалина и направляли на микроскопическое исследование.
Во время имплантации и удаления стентов во всех случаях животным в/в вводили 5 000 МЕ нефракционированного гепарина. После имплантации и до момента удаления стента всем животным подкожно вводили низкомолекулярный гепарин - надропарин кальция в дозе 2 850 МЕ 2 раз в сутки.
Результаты проведенных исследований
Имплантация 38 стентов прошла без осложнений. В двух случаях стенты раскрывались не полностью, что требовало баллонной дилатации внутри стента. В двух других случаях отмечалась дистальная дислокация стентов. В этих случаях репозиция стентов была достигнута после дополнительных внутрисосудистых манипуляций. Удаление 40 стентов прошло без осложнений. На 2, 3 и 7 сутки после имплантации все стентированные артериальные сегменты были проходимы. После удаления стента отмечен 1 случай спазма артерии, а в другом случае произошел острый тромбоз артерии сразу после удаления стента. Случаев поздней миграции или поломки стента не отмечалось, дистальной эмболии не было.
При макроскопическом осмотре через 1 сутки после имплантации на эндотелии артерий и аорты отмечены четкие следы от сдавливания ячейками стента, с участками субэндотелиального кровотечения и пристеночного тромбоза (рис. 2)
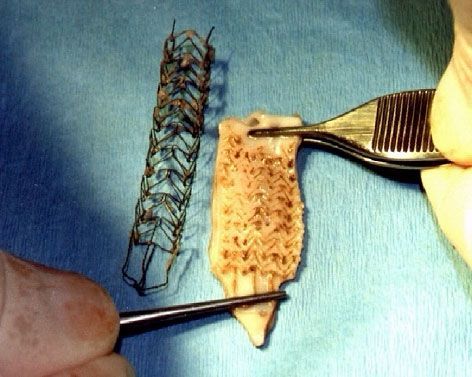
Рис. 2. Сегмент брюшной аорты свиньи после удаления временного стента. Стент (слева) удален на 2-е сутки после имплантации.
На 3 сутки макроскопическая картина была аналогичной (рис. 3)
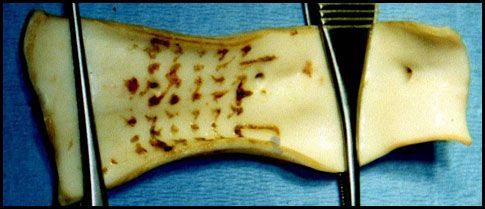
Рис. 3. Сегмент брюшной аорты свиньи после удаления временного стента. Стент удален на 3-е сутки после имплантации.
На 7 сутки несмотря на то, что следы от стента четко визаулизировались, эндотелиальная поверхность макроскопически выглядела наименее травмированной (рис. 4)

Рис. 4. Сегмент брюшной аорты свиньи после удаления временного стента. Стент удален на 7-е сутки после имплантации.
При морфологическом исследовании артериальных сегментов мышечного типа (аорты), во все сроки после удаления стентов, отмечено вдавливание внутренней эластической мембраны артерии элементами стента, с частичной потерей гладкомышечных элементов (Рис.5).
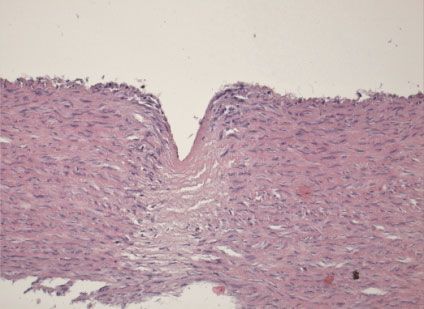
Рис. 5. Микропрепарат сегмента подвздошной артерии экспериментального животного. Вдавленный след от стента на 7 сутки, деструкция элементов гладкомышечного слоя артерии.
В артериях эластического типа (подвздошные артерии) наряду с вышеперечисленными изменениями обнаружены локальные очаги некроза гладкомышечных клеток. В зависимости от срока от момента постановки стента до его удаления изучаемые участки различались по количеству обнаруживаемого тромботического материала. Пристеночный тромбоз был наиболее выражен в артериях, где стент удаляли через 1 сутки. На 7-е сутки после удаления стента пристеночный тромбоз и субинтимальные кровотечения были наименее выражены.
Обсуждение полученных результатов
Идея временного устройства для устранения опасного осложнения баллонной ангиопластики – окклюзирующей диссекции интимы – не нова. Перфузионные баллоны появились на заре эндоваскулярной кардиологии [3]. Они позволяли проводить длительную баллонную дилатацию как бы "приклеивая" отслоенный участок интимы, сохраняя при этом минимальный уровень кровотока дистальнее участка поражения. В ряде случаев, этот способ позволял устранить диссекцию [4]. С появлением стентов, проблема диссекции внутри артерии стала практически решаемой. Имплантация стента стала рутинной процедурой, потому как позволяет добиваться лучших непосредственных и отдаленных результатов по сравнению с баллонной ангиопластикой. В то же время рестеноз внутри стента вследствие гиперплазии интимы, как реакции на имплантант, отмечается в 15-50% случаев после эндопротезирования . Удаление стента спустя некоторое время после имплантации, теоретически может быть лишено этого недостатка. Технически этого можно выполнить различными путями. Есть экспериментальные исследования по использованию временных стентов из нитинола, обладающих эффектом "памяти" ([5;[6]). Быстрое согревание теплым физиологическим раствором позволяет "свернуть" стент до минимального диаметра и удалить через доставляющее устройство. Несовершенство конструкции подобных стентов и риск термической травмы не позволили внедрить эти разработки в клинику. Другой подход – использование стентов спиралевидной конструкции, которые скручиваясь уменьшаются в диаметре и могут быть удалены через катетер [7]. Как известно, стенты спиральной конструкции не обладают достаточной радиальной жесткостью и в связи с этим на сегодняшний день в клинической практике практически не используются.
Нам не известны работы, в которых использовался бы временный стент, основу которого составляет апробированный и внедренный в клиническую практику стент. Ряд положительных качеств ZA-стента, из которых следует отметить высокую радиальную жесткость, отсутствие укорочения и гибкость, позволяют использовать его самых различных клинических ситуациях. В нашей работе доказана принципиальная возможность безопасного удаления ранее установленного временного ZA-стента. Это технологическое достижение. Показано, что первичный эффект стентирования сохраняется и после удаления стента. Экспериментально установлено, что наиболее оптимальным сроком для удаления временного стента являются 7 сутки. Если дальнейшие клинические исследования подтвердят эффективность временных стентов, то в будущем возможно использование временных стентов как фармакологических матриц для прицельной доставки в эндотелий артерий субстанций, обладающих антипролиферативным, цитостатическим или противовоспалительным действием.
Заключение
Хочется отметить, что в нашем исследовании оценивались только непосредственные результаты применения временных стентов. Безусловно эффект должен быть оценен и в отдаленном периоде. Техника имплантации и удаления временного стента отработана на животных с интактными артериями. Безусловно полученные результаты не могут быть полностью экстраполированы на больных атеросклерозом.
Тем не менее, можно отметить, что в экспериментальном исследовании продемонстрировано принципиальная возможность безопасной постановки и удаления временных сосудистых стентов. Показано, что сосудистая стенка после удаления временного стента претерпевает минимальные изменения. Наиболее оптимальным сроком удаления временного стента следует считать 7 сутки после имплантации.
Литература
- Rankin JM, Spinelli JJ, Carere R.G., et al. Improved clinical outcome after widespread use of coronary-artery stenting in Canada. N Engl J Med 1999; 341:1957-65
- Edelman ER, Rogers C. Pathobiologic responses to stenting. Am J Cardiol 1998;81;4-6E.
- Heuser RR, Mehta S, Strumpf RK. ACS RX flow support catheter as a temporary stent for dissection or occlusion during balloon angioplasty: initial experience. Cathet Cardiovasc Diagn 1992;27(1):66-74
- Gibbs JS, Sigwart U, Buller NP. Temporary stent as a bail-out device during percutaneous transluminal coronary angioplasty: preliminary clinical experience. Br Heart J 1994;71(4):372-7
- Eigler NL, Khorsandi MJ, Forrester JS, Fishbein MC, Litvack F. Implantation and recovery of temporary metallic stents in canine coronary arteries. J Am Coll Cardiol 1993;22(4):1207-13
- Rechavia E, Fishbien MC, DeFrance T, Nakamura M, Parikh A, Litvack F, Eigler N.Temporary arterial stenting: comparison to permanent stenting and conventional balloon injury in a rabbit carotid artery model. Cathet Cardiovasc Diagn 1997; 41 (1):85-92
- Stefanadis C, Kallikazaros L, Vlachopoulos C, Stratos C, Triposkiadis F, Toutouzas K, Toutouzas P. A new adjustable temporary stent catheter for management of acute dissection during balloon angioplasty. Cathet Cardiovasc Diagn 1996;37(1):89-98
