В настоящее время лапароскопическая холецистэктомия является одним из наиболее популярных методов лечения холелитиаза как в нашей стране, так и за рубежом. Эта операция заслуженно считается «золотым стандартом» лечения желчекаменной болезни. Её внедрение позволило значительно снизить число послеоперационных осложнений, сократить сроки стационарного лечения и период реабилитации больных.
Одним из факторов сдерживающих широкое внедрение лапароскопических технологий в хирургии до настоящего времени является трудности дифференциации и выделения важных анатомических структур в условиях ограниченной видимости при выполнении операции через лапароскопический доступ.
Бурный рост числа эндовидеохирургических вмешательств, по данным различных авторов, в период освоения техники сопровождался значительным увеличением количества, и тяжести интраоперационных осложнений, связанных с ятрогенным повреждением внепечёночных желчных протоков и проходящих в зоне анатомирования крупных артериальных магистралей (27, 50, 68). По мере накопления опыта лапароскопических операций число этих осложнений снизилось, однако и сегодня многие хирурги с сомнением относятся к перспективам выполнения холецистэктомии с использованием лапароскопической техники. Согласно данным зарубежных авторов в Европе и США ятрогенное повреждение внепечёночных желчных протоков при лапароскопической холецистэктомии отмечается в 0%-2,7% случаев (8,15,27,30,37), а по данным российских хирургов это осложнение встречается от 0,18% до 1,75% случаев (2-5).
Повреждение ветвей пузырной и печёночной артерий менее подробно освещены в литературе. По данным В.В. Стирижелевского и соавт. (3) на 4000 лапароскопических холецистэктомий у 26 пациентов возникло кровотечение из ветвей пузырной артерии и у 69 массивное кровотечение из ложа желчного пузыря. В 4 из этих случаев для устранения осложнений авторы вынуждены были прибегнуть к конверсии.
Большинство хирургов причину интраоперационных осложнений видят в наличии выраженных рубцово-инфильтративных изменений в гепатодуоденальной связке, приводящих к значительному изменению анатомии (26,62). Однако немаловажное место в опасности этих повреждений играют и атипичные варианты анатомии расположения внепечёночных протоков и ветвей печёночных артерий. И, действительно, единственной опасностью поджидающей опытного хирурга при удалении так называемого «неосложненного» желчного пузыря является нестандартная анатомия в зоне гепатодуоденальной связки.
Анатомическим вариантам расположения внепечёночных желчных протоков, а также печёночных артерий и их ветвей посвящено огромное количество публикаций в научных журналах, учебниках и атласах (1,10,22,24,43,52,53). Казалось бы, вопрос подробно изучен анатомами, и знание это должно быть взято на вооружение практическими хирургами. Тем не менее, каждая встреча с нетипичным расположением анатомических структур в гепатодуоденальной связке ставит в тупик хирурга и нередко приводит к развитию подчас тяжёлых инвалидизирующих осложнений, частота которых долгое время не имеет тенденции к снижению.
На практике при выполнении лапароскопической холецистэктомии хирург дифференцирует и выделяет пузырный проток через сравнительно небольшое окно, образованное после вскрытия брюшины в области треугольника Кало. Всё разнообразие анатомических вариантов прохождения внепечёночных желчных протоков и ветвей печёночной артерии, столь подробно описанных в литературе, через такой небольшой доступ увидеть невозможно. Хирург видит только верхушку «айсберга» - того анатомического разнообразия расположения структур, которое скрыто в глубине тканей и может ему встретиться в процессе операции. Препарируя ткани в узком окне, он вынужден ориентироваться на те анатомические структуры, которые ему доступны в этом сравнительном небольшом операционном поле. Ситуацию усложняет и то обстоятельство, что трубчатые образования на экране монитора часто трудно поддаются определению, невозможна и тактильная их ревизия. И, только опыт, и владение определенными техническими приемами помогают в такой ситуации избежать ятрогенных осложнений.
Целью настоящего исследования является анализ вариантов анатомического строения треугольника Кало в условиях лапароскопического доступа и их классификация, а также отработка практических приёмов, направленных на предупреждение возможных ятрогенных повреждений внепечёночных желчных протоков и ветвей печёночной артерии в зоне операции.
С 1991 по 2007 в ЦЭЛТ было выполнено 11068 лапароскопичесикх холецистэктомий. С 2004 по 2006 год нашей группой в процессе выполнения 2673 холецистэктомий по поводу неосложненного холецистита были детально проанализированы анатомические варианты желчного пузыря, прохождения внепечёночных желчных протоков и ветвей печёночной артерии в зоне препарирования гепатодуоденаольной связки и треугольника Кало. Любые отклонения от классической анатомии были зарисованы и подробно описаны в протоколах операций. По мере накопления опыта эндовидеохирургических вмешательств, все варианты были систематизированы и проанализированы с точки зрения опасности интраоперационных осложнений во время выполнения лапароскопической холецистэктомии.
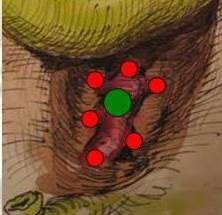
Из 2673 пациентов у 1910 (71,5%) анатомия треугольника Кало соответствовала классическим представлениям. К таким вариантам мы относили случаи, когда после рассечения брюшины на переднем плане визуализировался пузырный проток, слева и в глубине связки отдельным стволом - пузырная артерия (фото 1).
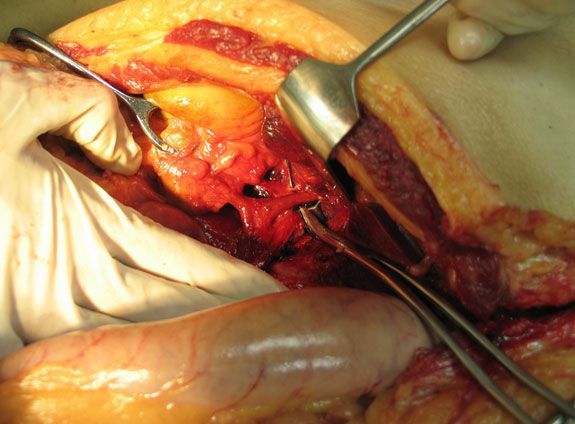 |
| Фото 1. Фотография треугольника Кало, выделенного на трупе |
Последняя могла быть представлена двумя стволами, либо делиться на преднюю и заднюю ветви непосредственно у стенки пузыря.
В 802 случаях (31%) из 2673 мы столкнулись с атипичными вариантами анатомии, потребовавшими изменения интраоперационной тактики. Все эти случаи мы разделили на две группы: варианты анатомии желчных протоков и варианты анатомии артериальных ветвей.
Варианты атипичной анатомии желчных протоков встретились нами в процессе выполнения 465 (17,4%) холецистэктомий.
Длинный пузырный проток, вызвавший трудности при его идентификации встретился у 200 (7,5%) больных (рис.1).
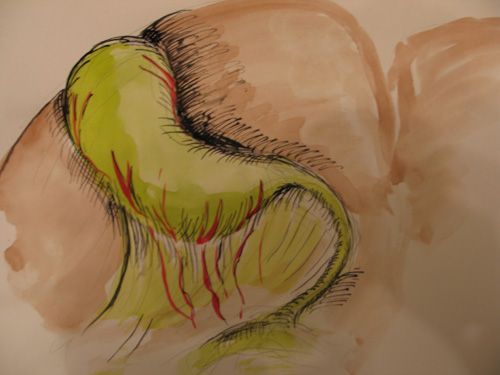 |
| Рис.1. Длинный пузырный проток |
В ряде случаев он шел вдоль общего печеночного протока и был интимно связан с последним. Технических трудностей такой вариант анатомии не вызывал, однако, мы старались выделить пузырный проток ближе к месту его падения в общий печеночный проток, чтобы избежать синдрома «длинной культи» после операции.
Короткий пузырный проток был выявлен у 179 больных (6,7%) (рис.2). Такой вариант несет в себе опасность повреждения холедоха при грубых манипуляциях в зоне устья пузырного протока. В нашем исследовании в 2 случаях повреждение холедоха было произведено именно при таком варианте анатомии.
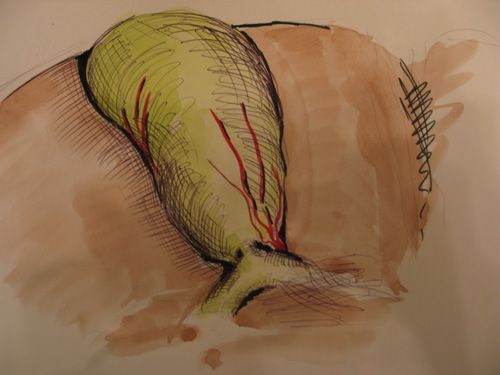 |
| Рис. 2. Короткий пузырный проток |
Однако, интимное спаяние стенки желчного пузыря с холедохом может и не быть следствием воспалительного процесса. В одном наблюдении мы обнаружили вариант, при котором пузырный проток и стенка пузыря на большом протяжении располагались вдоль печеночного протока и были интимно сращены с его стенкой, находясь в одной соединительнотканной муфте. Отделение тканей проводили крайне аккуратно. Во время операции повреждения структур обнаружено не было. На 14 день после операции больная была доставлена отделение с клиникой острого живота. На операции был выявлен массивный желчный затек в над- и подпеченочном пространстве. При ревизии было обнаружено, что в месте отделения от пузыря наступил некроз передней стенки холедоха, из которого поступала желчь. Учитывая, что при разделении тканей на операции нами были клипированы и пересечены несколько мелких сосудов идущих от пузыря к стенке холедоха, то вероятной причиной некроза могла стать ишемия этой зоны печеночного протока. Было произведено наружное дренирование холедоха, санация, дренирование брюшной полости. Через 6 месяцев больная оперирована, выполнено билиодигестивное дренирование на отключенной по Ру петле. Выздоровление.
Атипичную анатомию пузырного протока мы наблюдали у 6 из 2673 пациентов. Из них в 4 случаях (0,15%) (рис.3) пузырный проток впадал в правый печеночный, в других 2 – х(0,08%) – было выявлено наличие двух пузырных протоков, впадающих в общий печеночный проток. Подобные варианты являются достаточно редкими и трудно диагностируемыми.
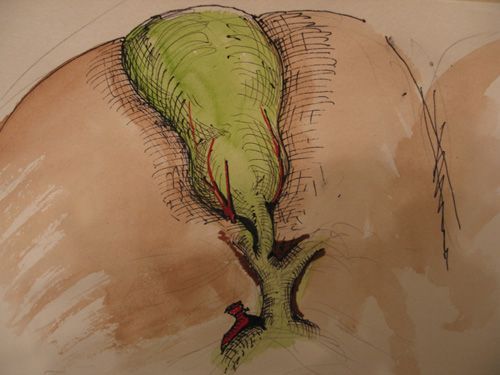 |
| Рис.3. Впадение пузырного протока в правый печёночный |
Правильная оценка ситуации, когда после клипирования и пересечения пузырного протока, хирург, вдруг обнаруживает второе трубчатое образование идущее к желчному пузырю весьма сложная задача. При этом в одном наблюдении второй пузырный проток проходил вдоль пузыря, интимно был с ним спаян и впадал в него в фундальном отделе (рис.4).
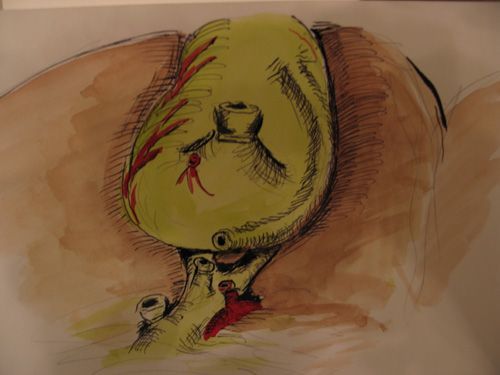 |
| Рис. 4. Два пузырных протока |
В 4 из 6 этих случаев мы вынуждены были перейти на конверсию. В 2 случаях при обнаружении второго пузырного протока и отхождения пузырного протока от правого печёночного нам удалось уточнить анатомическое строение с помощью интраоперационной холангиографии, что помогло избежать лапаротомии.
Дополнительные печеночные протоки в виде небольших по диаметру тонкостенных трубчатых структур были выявлены у 9 (0,3%) больных. Все они брали начало из правой доли печени и впадали в общий желчный проток выше места вхождения в него пузырного протока. В 5 случаях эти протоки были визуализированы нами в процессе препаровки тканей гепатодуоденальной связки. В остальных субсегментарные аберрантные протоки были выявлены на холангиограммах. Каналы Люшка в процессе выделения желчного пузыря были обнаружены нами у 69 больных (2,6%) (рис5.).
 |
| Рис.5. Дополнительные протоки. Проток Люшка |
В большинстве этих случаев каналы имели диаметр, достигающий 1 мм. Различие между каналом Люшка или небольшим абберантным субсегментазным печеночным протоком весьма незначительны, поэтому при появлении желчеистечения из ложа в процессе выделения пузыря следует, прежде всего понять, не произошло ли ранения внутрипеченочных сегментарных протоков, которые могут проходить поверхностно под ложем пузыря. Эта ситуация требует катетеризации и проведения холангиографии для определения характера повреждения. В нашей работе нам удалось избежать подобных конфликтов. Наличие канала Люшка подтверждали фактом его впадения в пузырь. При разделении канала считаем необходимым его клипирование с последующей, тщательной коагуляцией этой зоны ложа пузыря, что помогает избежать желчеистечения в послеоперационном периоде. Киста желчного протока была обнаружена в 2 случаях (0,08%). Такой вариант анатомии в виде мешотчатого расширения общего желчного протока встретился нам в период освоения методики. Оба случая не были диагностированы до операции и явились операционной находкой. Учитывая отсутствие холедохолитиаза и других каких либо осложнений мы не расширяли объем операции и ограничились удалением желчного пузыря.
Наш опыт включает и более редкие наблюдения, которые не вошли в исследование включающее 2673 операций. Наше сообщение не было бы неполным, если бы мы обошли вниманием эти случаи, тем более, что столкновение с такими вариантами анатомии у ряда больных повлияло на исход операции.
В 2-х случаях из 11068 мы не смогли обнаружить желчный пузырь, несмотря на данные предоперационного обследования, указывающие на его наличие. Операции закончены лапароскопией.
На двух операциях был выявлен желчный пузырь, ложе которого находилось в левой доле печени. Выделение такого пузыря прошло без особенностей, но потребовало нестандартного доступа, смещенного влево.
Удвоенный желчный пузырь имел место в одном наблюдении.
В одном случае на 11068 операций мы встретились с очень сложным вариантом расположения и состояния правого печеночного протока. Не имея достаточного опыта, на тот период времени, мы не смогли избежать конфликта. Приводим клинический пример:
Больная М. 38 лет поступила в хирургическое отделение ЦЭЛТ 18.04.93 г. с жалобами на боли в правом подреберье после приема пищи. В анамнезе: ЖКБ в течение 5 лет. Перенесла надвлагалищную ампутацию матки. Обследована амбулаторно. Анализы крови и мочи без патологии. На УЗИ желчный пузырь не увеличен в размерах. Стенки утолщены. В просвете пузыря множественные ЭХО - тени плотных включений до 1,5 см с акустической тенью. Холедох до 0,6 см.
Больная оперирована в плановом порядке. Под ЭТН произведена лапароскопия. При осмотре печень не увеличена, красно-коричневого цвета. Желчный пузырь обычной формы, без сращений. После тракции пузыря рассечена брюшина гепатодуоденальной связки в области шейки пузыря. Без технических трудностей выделены пузырный проток, и артерия, лигированы, пересечены. При дальнейшем выделении пузыря, ножницами было задето тонкостенное трубчатое образование, проходившее сзади от пузыря у его заднее-боковой стенки. Проток был настольно тонким, что практически остался бы незамеченным, если бы не капля желчи, выделившаяся в месте конфликта с инструментом. При ревизии выявлено, что проксимальный отдел протока уходит в ворота печени. Проток канюлирован мочеточниковым катетером. При этом тонкий катетер диаметром 1 мм с трудом зашел в просвет протока, стенка которого была настолько тонкой, что сквозь нее видны были метки катетера. Мы были практически уверены, что пересекли случайно какой-нибудь мелкий сегментарный проток. Однако при ИОХГ было обнаружено, что поврежден правый печеночный проток. После холецистэктомии операция закончена наружным дренированием правого печеночного протока, дренированием брюшной полости.
В послеоперационном периоде была произведена контрольная ЭРПХГ, которая подтвердила повреждение правого печеночного протока.
Больная была повторно оперирована через 6 месяцев. Произведена гепатикоеюностомия на отключенной по Ру петле тонкой кишки. Послеоперационный период прошел без осложнений, больная выписана на 14-е сутки после операции. Выздоровление.
Данный пример наглядно демонстрирует, как неожиданно рядовая, на первый взгляд, холецистэктомия привела к серьезному осложнению. При этом анатомия осталась неясной. Почему правый проток проходил в столь нетипичном для него месте, почему он был такой тонкий, где оказалась его дистальная часть? Все эти вопросы не нашли объяснения. Возможно, в рассматриваемом случае, мы встретили один из вариантов гипоплазии правого печеночного протока с атипичным его прохождением. Однако удовлетворения такое объяснение в плане профилактики осложнений при встрече с подобным анатомическим вариантом не доставляет.
Анатомические варианты кровоснабжения печени и желчного пузыря
Магистральный тип кровоснабжения желчного пузыря имел место у 2146 из 2673 больных, что составило 80,3%. При этом в 1910 случаях (89%) пузырная артерия проходила позади пузырного протока. В 172 случаях (8%) она находилась впереди пузырного протока и у 64 больных (3%) артерия проходила вдоль пузырного протока непосредственно примыкая к передней или задней его поверхности. Рассыпной тип в виде множественных мелких артериальных стволов идущих от правой ветви печеночной артерии или других источников встретился у 184 больных (6,9%).
 |
| Рис. 6. Рассыпной тип кровоснабжения желчного пузыря |
Часто такие сосуды проходили в удлиненной брыжейке пузыря (рис.6). Оба варианта мы расценивали, как типичную анатомию, не вызывающую технических трудностей при манипуляциях в зоне треугольника Кало. Следует помнить, что после лигирования и пересечения пузырной артерии не исключена возможность встречи со второй, или несколькими артериальными ветвями.
Гораздо более серьезную опасность представляет вариант, когда правая печеночная артерия образует изгиб вблизи шейки пузыря. Такой вариант мы встретили при выполнении 215 операций (8,1%).
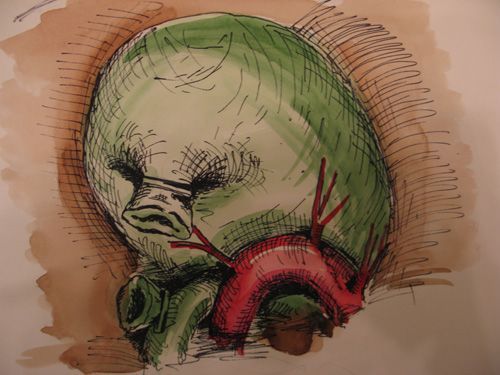 |
| Рис. 7. Дуга правой печёночной артерии у шейки пузыря |
Очень часто дуга правой печеночной артерии располагается сбоку и сзади шейки пузыря, бывает интимно спаяна с его стенкой (рис 7). В этом случае ее легко принять за пузырную артерию и лигировать, что может привести к серьезным последствиям. Учитывая это, при обнаружении крупных артериальных стволов мы не спешим клипировать, а производим тщательную ревизию задней стенки шейки пузыря в глубине связки с целью обнаружения второго колена дуги артерии. Тщательное отделение сосуда от стенки пузыря позволяет обнаружить короткие пузырные артерии, отходящие от дуги. Во всех случаях они представлены 3-4 стволами. Поэтому выделение одной пузырной артерии не должно успокаивать хирурга, следует ожидать встречи с другими ветвями, скрытыми в тканях. Кровотечение из этих ветвей остановить достаточно сложно, из-за опасности повреждения печеночной артерии.
Крупные артерии в ложе пузыря были обнаружены у 78 больных (2,9%) (рис.8).
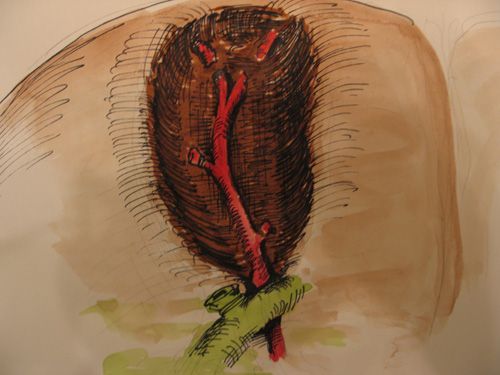 |
| Рис.8. Крупные сосуды в ложе пузыря |
Как правило, они давали ветви к задней стенки пузыря (рис.9). Во всех случаях нам удалось избежать повреждения сосудистой стенки, не смотря на то, что были варианты достаточно интимного прилежания сосуда к стенке пузыря. Выделение из ложа и клипирование сосуда в случае его повреждения может представлять значительные трудности.
 |
| Рис. 9. Крупный сосуд из ложа желчного пузыря |
Крупные венозные синусы в ложе пузыря мы обнаружили в 48 случаях (1,8%). Обычно при выделении задней части пузыря они выглядят в виде крупных выбухающих синюшного цвета стволов идущих вдоль ложа с впадающими в них венозными притоками (рис.10). Тонкая стенка синуса легко повреждается при выделении пузыря, что сопровождается довольно массивным кровотечением, остановить которое в ряде случаев бывает трудно. Замешательство при его остановке может привести к значительной кровопотере или нежелательным осложнениям, которые возникли у нас в двух случаях.
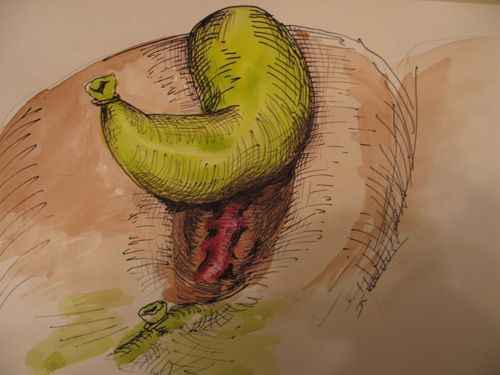 |
| Рис. 10. Крупный венозный синус в ложе желчного пузыря |
В одном из них мы вынуждены были перейти на конверсию, т.к. не смогли справиться с кровотечением из лапароскопического доступа. В другом – слишком упорная коагуляция зоны кровотечения привела к глубокому некрозу печеночной ткани с повреждению долевого протока. На 2 сутки после операции мы вынуждены были взять больную с клиникой острого живота на повторную операцию. При релапароскопии в дне коагуляционного некроза был визуализирован небольшого диаметра проток с дефектом, из которого поступала желчь. Проток дренирован, произведена санация желчного затека, дренирование подпеченочного пространства и брюшной полости. Послеоперационный период протекал без осложнения. Дренаж из протока удален на 20-е сутки после релапароскопии. Выздоровление.
Следует отметить, что кровотечение из венозного синуса иногда трудно остановить коагуляцией. Другого способа гемостаза в такой ситуации нет. Чтобы избежать глубоких некрозов, мы стали точечно коагулировать ткани вокруг источника кровотечения, что по нашему мнению прекращает поступление крови из притоков. После заметного ослабления активности кровотечения мы коагулируем непосредственно его очаг (рис.11). Такой прием позволяет без лишней травмы надежно контролировать венозные кровотечения из ложа любой интенсивности, без последующих осложнений.
 |
| Рис. 11. Остановка кровотечения из венозного синуса коагуляцией |
Крупные сосуды проходящие у стенки желчного пузыря мы встретили в 2 случаях (0,08%) (рис. 12). Артериальные стволы, довольно крупного диаметра проходили по переднее-боковой стенки пузыря от правой печеночной артерии и уходили в паренхиму печени, отдавая к стенке пузыря несколько мелких ветвей.
 |
| Рис. 12. Аномальный артериальный сосуд у стенки желчного пузыря. |
Учитывая внушительный диаметр сосуда, мы не решились его лигировать, ограничившись клипированием и пересечением только ветвей, идущих к стенке пузыря. Основной ствол оставался интактным после отделения от стенки и удаления пузыря.
Всякие отклонения от анатомической «нормы», обычно берут начало в нарушениях развития первичных зародышевых зачатков. Желчный пузырь и печень появляются, как вентральный «печеночный» дивертикул из каудального конца передней кишки. Этот дивертикул разделяется на две части: большую краниальную, (часть печеночную), которая является зачатком печени. Каудальная почка формирует желчный пузырь. Поворот двенадцатиперстной кишки выравнивает в линию общий желчный проток дорзально между поджелудочной железой и двенадцатиперстной кишкой (1,13). Варианты анатомического строения внепеченочных желчных протоков и расположения желчного пузыря начинаются с отклонений развития на четвертой неделе гестации (1). Развитие вариантов может возникнуть в желчном пузыре, желчных протоках и соответствующих артериальных структурах.
Частота нестандартного анатомического строения внепеченочных желчных протоков по данным большинства исследований встречается в 20- 30% случаев (1,45,47,48). Хотя многочисленные исследования основанные на операционных находках, данных эндоскопических и рентгенологических исследований, результатах аутопсий описывают частоту анатомических вариантов билиарной системы достигающей 47% (14,17,23,36,39,42).
Анатомические вариации билиарного дерева ведут к различным вариантам развития соответствующих артериальных структур (48). Аномальные варианты анатомии ветвей печеночных артерий встречаются примерно в 20% случаев (1). По данным других источников анатомия артерий, кровоснабжающих желчевыводящую систему гораздо разнообразнее, чем анатомия самой протоковой системы и аномалии ее развития встречаются чаще (10,25,41,54).
Следует согласиться с мнением M. Lamah и G.H. Dicson (46), что в процессе лапароскопической операции хирург имеет весьма ограниченные возможности для обзора и анатомирования мелких анатомических регионарных структур в отличие от препаровки на трупах, а эндоскопические и рентгенологические исследования выполняются не у всех больных. Из 2125 холецистэктомий, только в 12 случаях (0,58%) авторы обнаружили аномалии внепеченочных желчных протоков, справедливо отмечая, что малый процент находок не отрицает наличия абберантных протоков, которые могут быть не видны, если манипуляции хирурга преимущественно ограничиваются треугольником Калот и производятся у шейки пузыря.
В нашем исследовании мы также демонстрируем результаты операционных находок выявленных в процессе использования лапароскопического доступа. Всего нестандартная анатомия внепеченочной протоковой и артериальной систем встретились нам у 31% больных (рис.13).
 |
| Рис.13. Частота аномальных вариантов анатомии |
Из них варианты анатомии желчновыводящих протоков отмечены в 17,4% случаев. Нормальная анатомия треугольника Калот была имела место в 69% случаев. Это несколько расходится с данными M. Larobina и P. Nottle (48) из Автралии, которые сообщили о 88% случаев нормальной анатомии треугольника. За норму авторы принимали такое взаимоотношение, когда пузырный проток находился впереди ствола пузырной артерии. Обратное расположение, когда артерия находилась впереди пузырного протока авторы встрелили в 9% случаев. У 2% больных артерия лежала непосредственно на протоке. M. Suzuki и соавт. (67) исследуя особенности вариантов артериального сплетения пузырного протока, отметили нормальную анатомию треугольника Калот в 76,6% случаев.
Как было отмечено выше длинный пузырный проток, встретившийся в нашем исследовании в 7,5% случаев не представляет опасности ятрогенного повреждения. Обычно такой вариант сочетается с повышенной подвижностью желчного пузыря, часто имеющего структуру, напоминающую брыжейку. По данным литературы в ¼ случаев пузырный проток идет параллельно общему желчному протоку и может дренировать последний в различных зонах, вплоть до двенадцатиперстной кишки (1).
M.J. Shaw и соавт. (64) сообщили, что низкое соединение пузырного протока с общим печеночным протоком и спиральное обвитие пузырного протока вокруг последнего было обнаружено в 7% случаев. Ряд авторов, основываясь на данных эндоскопических и рентгенологических исследований отметили, что «нормальное» боковое вхождение пузырного протока в общий желчный втречается только в 17-35% случаев (8,64).
Более серьезную опасность для хирурга представляет короткий пузырный проток, который мы обнаружили у 6,7% больных. Причиной такой аномалии могут быть хронические рубцово-воспалительные изменения желчного пузыря, приводящие к укорочению пузырного протока в 5-10% случаев. Такой же тип врожденного отсутствия пузырного протока встречается значительно реже в 0,14-0,67% (6,18,46).
Особенного внимания требуют случаи, когда шейка пузыря не имеет кармана и плавно переходит в общий желчный проток. В ряде случаев создается впечатление, что пузырь широким основанием соединяется с холедохом. Такие варианты следует дифференцировать с синдромом Mirizzi и приступать к пересечению только после тщательного анатомирования зоны с контролем варианта анатомии с помощью ИОХГ.
Наиболее серьезную опасность представляет вариант, когда при исходно коротком пузырном протоке в результате рубцового процесса к задней стенке шейки пузыря подтягивается стенка общего печеночного протока. В нашем исследовании в 2 случаях повреждение общего желчного протока произошло именно при таком варианте анатомии. Тракция шейки пузыря вытягивает общий желчный проток, который хирург лигирует и пересекает принимая его за d. сisticus. Осознание трагедии происходит позже в процессе выделения пузыря, когда хирург, вдруг обнаруживает проксимальную часть гепатохоледоха. По данным исследований ряда Американских центров, такой механизм повреждения при использовании Американской техники является наиболее распространенным и назван «классическим повреждением» (21,26,62,65.). Он относится ко второму из трех вариантов, согласно классификации «классических повреждений» описанных в литературе (21,26,56,60). Как правило, повреждение приводит к резекции части общего желчного протока и может сопровождаться повреждением правой печеночной артерии. Согласно данным Soper и соав. (65) этот механизм осложнений возникает в 67% среди всех повреждений печеночных протоков в процессе выполнения лапароскопической холецистэктомии.
Профилактика такого механизма повреждения заключается в тщательной препаровке зоны впадения пузырного протока в желчный пузырь. Манипуляцию следует начинать у шейки пузыря и продолжать вниз и по задней его стенке, отделяя пузырь от ложа. При этом клипируются и пересекаются пузырные сосуды, формируется окно, образованное задней стенкой шейки пузыря, пузырным протоком и ложем. В ряде случаев мы выделяли практически весь пузырь не пересекая протока. Тщательное отделение пузыря позволяет во время обнаружить подтянутый общий желчный проток и избежать конфликта с ним. Такую диссекцию мы называем прием «хобота» (фото.2). При малейшем подозрении на нетипичную анатомию протоков, производим ИОХГ.
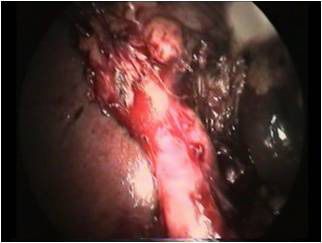 |
| Фото.2. Приём "хобота" |
Кровоснабжение общего желчного протока происходит за счет тонких ветвей эпихоледохеального сплетения. Питание сверху обеспечивают печеночные и пузырная артерии, снизу – гастродуоденальная и ретродуоденальная артерии (1). Лигирование ветвей этого сплетения, по всей видимости, и явилось причиной ишемического некроза, возникшего у одной нашей больной в послеоперационном периоде.
Наличие двойного пузырного протока описано во многих исследованиях и по мнению авторов, встречается крайне редко (28,40,57,59). M. Lamah и G.H. Dicson (46), обнаружили двойной пузырный проток у одного из 2125 больных (0,05%) в процессе выполнения холецистэктомии. Еще в одном случае авторы описали удвоение пузырного протока, который сливался в один перед впадением в общий желчный проток. Эти данные почти совпадают с нашими, двойной пузырный проток обнаружен был нами в 0,08% случаев. Если такой вариант не заметить во время операции, послеоперационный период может осложниться желчеистечением.
Дренирование пузырного протока в правый печеночный проток, выявленное нами в 0,15% случаев, является одним из наиболее коварных анатомических вариантов, приводящих к ятрогенным осложнениям.
Частота такой аномалии по данным различных авторов варьирует от 0,1% до 2,3% (44,46,61). Опасность этих вариантов состоит в том, что правый печеночный проток ошибочно может быть принят за пузырный и пересечен после лигирования в месте соединения с левым протоком. Такой механизм повреждения, как наиболее часто встречаемый, согласно принятой в литературе классификации, относится к третьему типу вариантов «классического повреждения протоков» (26,33).
Гораздо реже пузырный проток впадает в левый печеночный проток (20,32). В том же исследовании M. Lamah и G.H. Dicson (46) у одного больного (0,05%) с нормальным расположением желчного пузыря, выявили пузырный проток, который минуя сзади правый печеночный впадал в левый печеночный проток. В этой ситуации ятрогенное повреждение более вероятно, особенно при лапароскопическом доступе. Тонкий печеночный проток на операции может быть ошибочно принят за пузырный, переходящий на левую сторону. В результате возникает реальная угроза повреждения правого печеночного протока. Возможно, в клиническом примере, описанном нами выше, механизм повреждения правого печеночного протока у больной имел сходные анатомические предпосылки.
Особое внимание в литературе уделяется описанию дополнительных абберантных печеночных протоков, наличие которых сопровождается повышенным риском их повреждения при выполнении лапароскопической холецистэктомии (18,19). Это аномально проходящие протоки, дренирующие отдельные сегменты печени (31,36). В нормальной печени связи между желчными протоками различных сегментов нет, и дополнительные протоки обеспечивают отток только из своих соответствующих сегментов печени. В большинстве случаев они возникают из правой доли печени, но иногда из левой доли, или каудальных долей и развиваются, сливаясь в более широкие структуры (19,44). Они могут выявляться, как абберантные протоки, дренирующиеся в протоковую систему либо высоко в воротах печени, или ниже в различных точках внепеченочной протоковой системы. Наиболее частый вариант, встречающийся в 5% случаев, когда субсегментарные протоки из правой доли печени дренируются в общий желчный проток ниже области впадения в него правого или левого протоков. Вторым по частоте является вариант, когда дополнительный проток дренируется в пузырный. (8,64,). Реже дополнительные протоки впадают непосредственно в желчный пузырь (9), и могут быть скрыты под ложем пузыря. Были описаны случаи дренирования в панкреатический проток (13).
В литературе имеются разногласия относительно частоты обнаружения таких форм анатомических аномалий. Некоторые исследования ограничиваются количеством инциндентов порядка 2% (16,51), другие утверждают, что это самая частая аномалия внепеченочных желчных протоков имеющая место в более, чем 30% случаев (38,55).
В своих исследованиях на трупах Moosman et al. (55) обнаружил такие варианты в 16% случаев. В 77% они были представлены в виде отдельного протока, в остальных – в виде комплекса состоящего из множественных и ветвящимися мелких протоков. В 85% случаев они проходили через треугольник Калот, в остальных миновали эту зону. При этом длина и диаметр дополнительных протоков значительно варьировали, достигая в длину 20,6 мм и имели диаметр порядка 2,6 мм. По мнению автора, если повреждение мелких протоков во время операции остается незамеченным и не сопровождается значительными последствиями, то повреждение больших по размеру структур может привести к желчеистичению, перитониту, желчному затеку, поддиафрагмальному абсцессу или формированию наружной фистулы.
В нашем исследовании дополнительные абберантные протоки были обнаружены у 0,3% больных. Это соответсвует данным исследования M. Lamay и G.H. Dicson (46), которые сообщили о наличии такого варианта анатомии в 0,24% случаев. Авторы не исключали тот факт, что из-за небольшого диаметра часто такие протоки могли быть незамечены.
В 69 случаях (2,6%) обнаруженные мелкие протоки в ложе пузыря мы описали, как протоки Люшка. Согласно литературным источникам (1) различия между каналом Люшка или небольшим абберантным субсегментазным печеночным протоком весьма незначительны. А в представленной литературе упоминание о наличии этих каналов крайне редки и неопределнны(1). Учитывая последнее, мы не исключаем, что в ряде случаев за протоки Люшка нами могли быть были приняты дополнительные субсегментарные протоки, клипирование которых не повлекло за собой значимых последствий.
Варианты Аномалии желчного пузыря, которые мы обнаружили в 5 случаях, в 2 из которых он находился на левой доле печени, в одном, имело место удвоение пузыря, и в остальных он отсутствовал, относятся к аномалиям его эмбрионального развития. Такие варианты хорошо описаны в литературе, хотя и проявляются редко в виде эктопии пузыря, наличии множественных отделов в его полости или его полном отсутствии, что полностью подтверждается результатами наших находок (36,47,48).
Переходя к обсуждению вариантов системы кровоснабжения, внепеченочного биллиарного дерева следует отметить, что начало всему разнообразию анатомических вариаций закладывается в эмбриональном развитии. Многочисленные сосуды, идущие к желточному мешку от двойной аорты проходят в брыжейке первичной кишки и питают кишечные структуры. Часть этих сосудов регрессируют, остаются чревная, верхняя и нижняя брыжеечные артерии. От чревной артерии берет начало печеночная артерия, которая проходит в брыжейке первичной кишки и питает печень и ее протоковую систему. Изменения в процессе формирования сосудистой сети приводят к многочисленным вариациям архитектоники внепеченочных артерий.
Вариантам артериального кровоснабжения внепеченочных желчных протоков посвящено много работ (1,10,22,25,48,52,54,63,67). Аномалии артериальной анатомии по данным литературы встречаются до 20% случаев (1,10,22,54).
Правая печеночная артерия - наиболее часто встречаемый крупный сосуд в зоне манипуляций при выполнении холецистэктомии. Конфликт с этим сосудом может привести к крупным неприятностям. По данным анатомических исследований в 17% имеет место аномалия отхождения правой печеночной артерии. Из них в 11% она отходит от верхней брыжеечной артерии, в 5 – от общей печеночной артерии, в 1% - от чревного ствола и в 1% она отходит непосредственно от аорты. В 7% случаев авторы отметили наличие дополнительных ветвей правой печеночной артерии. В 3% случаев дополнительные ветви отходили от верхней брыжеечной артерии, в 3% - от левой печеночной артерии, и один процент включает случаи ответвления аберрантных артерий от аорты, гастродуоденальной артерии или чревных ветвей (10,25,41,54).
E.P. Molmenti и соавт. (54) описали редкий случай отхождения пузырной артерии от верхней брыжеечной артерии, она имитировала правую печеночную артерию. На основании данных литературы включающей 500 диссекций (10,25,41) авторы отметили, что в 80% случаев общая печеночная артерия делится на правую и левую печеночные артерии около 4 см от печени. В остальных случаях деление происходит ниже, и сосуды идут к воротам, как две и более артериальные ветви.
В 98% случаев правая печеночная артерия расположена слева от общего желчного протока в остальных она располагается сзади или спереди протока. От 5% до 25% случаев правая печеночная ветвь визуализируется впереди и латерально от общего желчного протока (1,48).
В условиях лапароскопического доступа при выполнении холецистэктомии хирург в большинстве случаев не видит правой печеночной артерии и не манипулирует в проекции ее нахождения. Однако, всегда надо помнить о близком ее расположении и тех вариантах, когда она может находится в зоне диссекции. В нашем исследовании в 8,1% случаев мы встретили варианты, когда правая печеночная артерия образовывала колено и в виде дуги визуализировалась непоследственно у шейки пузыря, рядом с пузырным протоком. Как было отмечено выше, в этом варианте ее легко спутать с пузырной артерией. Как не парадоксально, при открытой холецистэктомии такой вариант дифференцировать сложнее, чем при лапароскопическом доступе, при котором хирург по увеличением имеет возможность снизу тщательно провести ревизию опасной зоны. Во всех 215 случаях нам удалось избежать конфликта с сосудом, хотя среди них были варианты, когда дуга артерии была плотно спаяна со стенкой пузыря, и ее выделение сопровождалось техническими сложностями. По данным литературы, выступающая правая печеночная артерия, описанная в виде «гусеницы», «петли» и т.д. встречается в 5 до 15% случаев (1,48,63). По мнению M. Laborina P. и Nottle (48) это наиболее частый вариант сосудистой аномалии, таящий в себе опасность пересечения артерии при неосторожной манипуляции. Мы не смогли проследить и не встретили в литературе ответ на вопрос: формирует ли дугу артерия, проходящая над общим печеночным протоком (что кажется более вероятным), или она формируется независимо от расположения сосуда?
В нашем наблюдении мы отметили, что во всех случаях от дуги отходили множественные (от 2 до 4) пузырные артерии. Они впадают в стенку пузыря короткими стволами и в ряде случаев довольно трудно дифференцируются хирургом. Поэтому, отделяя артериальную дугу, всегда следует помнить о наличии дополнительных пузырных артерий.
Варианты анатомии пузырной артерии так же весьма вариабельны, как по источнику происхождения, так и по месту и форме нахождения по отношению к треугольнику Калот. Знание этой анатомии имеет непосредственное отношение к безопасности хирургического вмешательства.
В 70-75% случаев пузырная артерия отходит от правой печеночной артерии (1,25,54). По другим данным анатомических исследований пузырная артерия в 48% случаев отходит от правой печеночной артерии, в 22% - от левой печеночной артерии, в 13% случаев она берет начало из дополнительной правой печеночной артерии, в 9% - из общей печеночной артерии, в 5%- из гастродуоденальной артерии, в 2% - от чревного ствола и в 1% она может отходить от верхней брыжеечной артерии ( 10,25,41,54). У шейки пузыря она делится на поверхностную и глубокую ветви. Кроме того, дает тонкую ветвь к пузырному протоку, которая идет по задней его поверхности и часто дает незначительные по своей интенсивности кровотечения в процессе выделения пузырного протока. По данным литературы пузырная артерия в виде отдельного ствола встречается в 21% - 88% случаев (1,48,54,67). Такой разброс данных связан скорее с различием операционных находок и данных анатомических исследований. Около ¼ случаев поверхностные и глубокие ветви пузырной артерии имеют отдельный источник. Глубокая пузырная артерия, как правило, отходит от правой печеночной артерии, в то время, как поверхностно расположенная пузырная ветвь может отходить от правой печеночной, общей печеночной, левой печеночной, гастродуоденальной или ретродуоденальной артерий (22,43,52).
В остальных случаях описываются варианты множественного кровоснабжения желчного пузыря. Однако большинство авторов, опираясь на данные операционных исследований, отмечают, что такой вариант кровоснабжения пузыря все-таки не является частым (1,48,67). В нашем исследовании магистральный тип кровоснабжения был выявлен в 80,3% случаев, рассыпной – в 19,7%. При этом, в 89% случаев пузырная артерия проходила позади протока, в 8% - она находилась впереди последнего и в 3% случаев артерия шла по пузырному протоку. Два последних варианта требуют определенной настороженности, поскольку не всегда на операции пузырный проток можно легко отличить от артерии. Подобные варианты описывают австралийские коллеги (48), которые описали нормальную анатомию треугольника Калот у 88% оперированных больных. В 9% случаев они обнаружили обратное соотношение, когда артерия находилась впереди пузырного протока, а у 4 больных (2%) артерия лежала прямо на протоке. При этом в 1% случаев авторы вообще не обнаружили пузырной артерии.
Подробно изучив артериальные сплетения треугольника Калот в процессе выполнения 244 лапароскопических холецистэктомий, M. Suzuki и соавт. (67) в 76,6% случаев описали нормальную анатомию пузырной артерии, когда она визуализировалась внутри треугольника Калот. В 11,1% случаев имели место двойные пузырные артерии и у 11,1% оперированных больных авторы вообще не обнаружили пузырных артерий в треугольнике.
Кроме того, у 6 больных авторы описали вариант, при котором пузырная артерия проходила вокруг пузырного протока, перетягивая его спереди у шейки пузыря. Авторы высказали мнение, что большинство случаев формирования камней в желчном пузыре происходит в результате замедления прохождения желчи или полной ее блокады в результате сдавления пузырного протока артерией. Таким образом, было сформировано новое понятие - «пузырный артериальный синдром», который сходен с синдромом правой печеночной артерии, описанной Endmund с соавт. еще в 1961 году (29).
M. Suzuki и соавт (67) разделили больных на 3 группы. В первую группу вошли случаи, когда отдельная или двойная пузырная артерия, имеющая один источник кровоснабжения, визуализировалась в треугольнике Калот. Вторая группа включала случаи множественного кровоснабжения желчного пузыря. В этой группе у 13 больных (5,3%) были описаны варианты кровоснабжения пузыря из сосудов, пронзающих ложе пузыря, и известные нам уже случаи (1,2%), когда артерия проходила сзади и вдоль пузырного протока. В третью группу вошли случаи, когда артерия не была обнаружена в треугольнике Калот. Группа подразделялась согласно числу источников кровоснабжения пузыря. Здесь также были описаны варианты прохождения пузырной артерии по пузырному протоку (1,2%) и кровоснабжение из ложа, которые авторы наблюдали у одного из 244 больных (0,4%). Эти данные имеют важное значение, поскольку в 2,9% случаев мы также встречали крупные артериальные стволы, кровоснабжающие желчный пузырь непосредственно из ложа пузыря. До ознакомления с литературой такие варианты интерпретировались нами, как аномальные.
Крупные сосуды проходящие у стенки желчного пузыря, обнаруженные нами в 0,08% случаев скорее относились к абберантным ветвям правой печеночной артерии. Описание подобных вариантов анатомии мы не встретили в литературе. Учитывая крупный диаметр сосуда мы рекомендуем избегать конфликта с последним во избежании нежелательных последствий в виде ишемических изменений соответствующих зон печени.
В литературе посвященной лапароскопичекой анатомии мы практически не встретили упоминаний о наличии венозных синусов в ложе желчного пузыря. Тем не менее, в 1,8% случаев мы наблюдали достаточно крупные стволы, и в одном случае кровотечение из него потребовало перехода на конверсию. По мере накопления опыта мы выработали эффективные приемы остановки кровотечения из поврежденного синуса, описанные нами выше.
В заключение обсуждения анатомических вариантов внепеченочных желчных протоков и их артериального снабжения хотелось бы отметить, что случаи повреждения протоков при выполнении лапароскопических операций имеют мультифакторную природу. Они включают особенности и ошибки лапароскопического доступа, опыт хирурга и локальные факторы риска (33). В нашей работе мы подробно обсудили первый и последний факторы. В литературе широко обсуждаются осложнения, связанные с опытом и подготовкой хирурга. Так Южный хирургический клуб в серии публикаций отметил, что частота повреждений печеночных протоков на первые 13 оперированных пациентов составила 2,2%, против 0,1% для последующих пациентов (68). Позднее та же группа отметила, что 90% таких осложнений в серии 8,839 лапароскопических холецистэктомий имело место на первые 30 случаев отработки техники (69). Используя статистическую модель регрессии они заключили, что риск повреждения внепеченочных желчных протоков достигал 1,7% в период первых холецистэктомий, в сравнении 0,57% , выполненных после опыта 50 операций. В штате Коннектикут Orlando et al. (58) показали, что 53% случаев повреждения печеночных протоков имели место у хирургов в процессе выполнения первых 10 лапароскопических холецистэктомий, 33% - при опыте от 11 до 50 операций и только 2 случая (13%) после 50 холецистэктомий. Deziel et al. (27) проведя обширный национальный обзор включающий 77,604 ЛХЭ сообщили о 0,6% случаев повреждений печеночных протоков и отметили, что значительно снижается число осложнений в институтах имеющих опыт более 100 операций. В Бельгии уровень осложнений составляет 1,3% у хирургов с опытом менее 50 операций (34). В 55% этих случаев операция была описана так «простая холецистэктомия» без каких-либо предрасполагающих локальных факторов риска для повреждения протока. Тем не менее, адекватный хирургический тренинг не предохраняет пациента против опасности ятрогенных осложнений. Около 1/3 пациентов с повреждением внепеченочных желчных протоков были оперированы хирургами, имеющими опыт более 100 операций, возникает это осложнение и после 450 и даже более лапароскопических холецистэктомий (34). Такая концепция «перманентного» риска повреждения желчных протоков в общей хирургической практике при лапароскопической холецистэктомии даже в опытных руках и, особенно в сложных случаях была недавно выведена в проспективных обозрениях США (11).
По нашему мнению этот «перманентный» риск ятрогенных повреждений при выполнении «простой» с первого взгляда холецистэктомии, выполняемой «опытными руками» хирурга и возникает с одной стороны в результате небрежной диссекции тканей в зоне треугольника Калот, чрезмерном использовании электрокоагуляции, в слепом накладывании клипс для остановки кровотечения; с другой, в дезориентации хирурга при встрече с аномальными анатомическими вариантами протоковой и артериальной систем, описанных в нашем исследовании.
Что касается первого фактора, он подтверждается данными обзора результатов лапароскопических вмешательств Бельгии, в котором было отмечено, что комбинация инструментального и термического повреждений при рассечении тканей крючком являлась вторым по частоте механизмом ятрогенных повреждений (1). Термическое повреждение вследствие электрокоагуляции имело место у 1/3 всех повреждений печеночных протоков (7,21,34,35,63).
«Анатомический фактор» показан в нашем исследовании. Несомненно риск ятрогенных осложнений при лапароскопических операциях пропорционален частоте аномальной анатомии внепеченочных протоков и артериальных сплетений.
В заключение хотелось бы отметить, что хирург при выполнении лапароскопической холецистэктомии должен четко «виртуально» представлять основную, часто скрытую, анатомию печеночно-двенадцатиперстной связки. Он должен помнить об «опасных» анатомических вариантах, затрагивающих зону треугольника Калот, описанных в нашем исследовании, находить ориентиры, этих аномалий и использовать описанные нами приемы, чтобы избежать нежелательного конфликта с желчными протоками и крупными артериальными стволами.
- Винд Д.Г. Прикладная лапароскопическая анатомия: брюшная полость и малый таз /Пер. с англ. под ред. проф. А.Н. Лызикова, д.м.н., проф. О.Д. Мядеца – М.: Медицинская литература, 1999. – 384 с.
- Галлингер Ю.И., Карпенкова В.И., Воробьев В.К. Повреждения гепатикохоледоха при выполнении лапароскопической холецистэктомии. //Анналы хирургической гепатологии. Современные проблемы хирургической гепатологии. 4-я конференция хирургов гепатологов (3-5.10.96): Материалы. Тула. 1996.- том1.- с. 278.
- Стрижелецкий В.В., Рутенбург Г.М., Михайлов А.П. Осложнения в абдоминальной хирургии. // Эндоск. Хир. 2000.- №5.- с 3-11.
- Тарасов А.Н. Шапошникова Т.А., Фомин В.Н., Дерябина Е.А. Устинов Н.А. Профилактика, диагностика и лечение ятрогенных повреждений желчных путей при лапаросокпической холецистэктомии. //Анналы хирургической гепатологии. 4-я конференция хирургов гепатологов (3-5.10.96): Материалы. Тула. 1996.- том1.- с. 301.
- Федоров И., Славин Л. Повреждения желчных протоков при лапароскопической холецистэктомии.// Казань. 1995. – 72с.
- Adam Y., Metcalf W. Absente of the cystic duct: a case report, the embryology and a review of the literature. // Ann. Surg. 1966. – vol. 164. – p. 1056 – 1058. (врож отсут пуз протока 0,14%)
- Adams D.B., Borowicz M.R., Wootton F.T., Cunningham J.T. Bile duct complications after laparoscopic cholecystectomy. // Surg. Endosc. 1993. – vol. 7. – p. 79-83. (терм повреж)
- Adkins R.B., Chapman W.S., Reddy V.S. Embryology, anatomy and surgical applications of the extrahepatic biliary system.// Surg.Clin.North.Am.-2000, - v.80.- p. 363-379. (частота повреждений протоков 0-1%.(норм соотн пуз пр и ОЖП 17-35%)
- Albared P., Chevalier J.M., Cronier P., Enon B., Moreau P., Pillet J. Accessory hepatic duct opening into the gallbladder or cystic ducts. // Ann. Chir. 1981.-vol. 35.-p. 88-92.
- Anson B.J., Mcvay C.B. Surgical anatomy, 6 th end.- vol. 1.- Philadelphia, PA: WB Saunders, 1984. – p. 664. (анатомия из молменти)
- Archer S.B., Brown D.W., Smith C.D., Branum G.D., Hunter J.G. Bile duct injuri during laparoscopic cholecystectomy. Results of a national survey. // Ann. Surg. 2001.- vol. 234. – p. 549-559.
- Asbun H.J., Bossi R.L., Lowell J.A., Munson J.L. Bile duct injury during laparoscopic cholecystectomy: mechanism of injury, prevention and management. // World.J.Surg. 1993.-vol 17.-h.547-552.).
- Atlas H., Jacquemin J.P. Rare abnormality of the extrahepatic bile ducts. // Accessory hepatic duct opening into the middle of Wirsung’s duct. // J. Chir.(Paris) 1972.-vol. 104.-p. 591-594.
- Auld C.D. The common bile duct and its anjmalies.//J.R.Coll.Surg. Edinb. 1985.-vol. 30.-p. 248-250.(47%) (варианты ЖП до 47% ---- до John)
- Barwood N.T., Valinsky L.J., Hoobs M.S., Fletcher D.R., Knulman M.W., Ridout S.C. Chaging methods of imaging the common bile duct in laparoscopic era in Western Australia.// Ann. Surg.-2002.-v.235.- p. 41-50. (0-1% повреждений)
- Benson E.A., Page R.E. A practical reappraisal of the anatomy of the extrahepatic bile ducts and arteries. // Br. J. Surg. 1976.- vol. 63.- p. – 853-860.
- Bercу G. Biliary duct anatomy and anomalies. The role of intraoperative cholangiography during laparoscopic cholecystectomy. // Surg.Clin.North.Am. 1992. – vol. 72. - p. 1069-1075.
- Bogardus G.M., Lundmark V.O. The short or absent cystic duct. // Surgery. 1969. – vol. 65. – p. 274-275. (врож отсут пуз прот)
- Boyden E.A. Congenital variations of the extrahepatic billiary tract: a review. // Minn. Med. 1944.- vol. 27.-p. 932. (доп проток)
- Brandt C.P., Eckhauser M.L. Rare bile duct anomalies. A case report and implications for laparoscopic cholecystectomy. // Surg. Endosc. 1994.-vol. 8.- p. 329-331.(3 тип мех поврежд)
- Branum G., Schmitt C., Baille J., Suhocki P., Baker M., Davidoff A., Branch S., Chary R., Cucchiaro G., Murray E., Pappas T., Cotton P., Meyers W.C. Management of major biliary complications after laparoscopic cholecystectomy. // Ann. Surg. 1993. – vol. 217. –p. 532-541 (классич повр. ЖП).
- Browne E.Z. Variations in origin and course of the hepatic artery and its branches. // Surgery.1940. – vol. 8.- p. 424-445. (ист пуз артерии стр 13текста)
- Charels K., Kloppel G. The bile duct system and its anatomical varianions. // Endoscopy 21. - 1989.- Suppl. 1. – p. 300-308.
- Cullen J.J., Scott –Conner CEN. Surgical anatomy of laparoscopic common duct exploration. In.: Berci G., Cuschieri A. (eds.) Bile ducts and bile duct stones. W.B. Saunders, Philadelphia, pp 20-25. (Cузуки (общая анатомия)
- Daseler E.H., Anson B.A., Hambley W.C., Reimann A.F. The cystic artery and constituents of the hepatic pedicle. A study of 500 specimens. // Surg. Gynecol. Obstet. 1947.-vol. 85.-p. 47-63. (анатомия из молменти)
- Davidov A.M., Pappas T.N., Murray E.A., Hilleren D.J., Jonson R.D., Baker M.E., Newman G.E., Cotton P.B., Meyers W.C. Mechanisms of major biliary injury during laparoscopic cholecystectomy. // Ann. Surg. 1992. – vol. 215. –p. 196-202.
- Deziel D.J., Millikan K.W., Economou S.G., et al. Complications of laparoscopic cholecystectomy: A national survey of 4,292 hospitals and an analysis of 77,604 cases. //Am. J. Surg. 1993.-vol.165.-h.9-14.*
- Dia A., Venditelli Valleix D., Descottes B. Le canal cystique double. A propos d’un cas. //Ann.Chir. 1989.- vol. 43.- p. 306-308.
- Edmund M., Luttwak M., Schwartz A. Jaundice due to obstruction of the common duct by aberrant artery. // Ann. Surg. 1961.- vol. 153. – p. 134-137.
- Fletcher D.R., Hobbs M.S., Tan P et al. Complications of cholecystectomy: risks of the laparoscopic approach and protective effects of operative cholangiography: a population based study. // Ann. Surg.-1999.-v.229.- p. 449-457. (0-1% повреждений)
- Foster J.H., Wayson E.E. Surgical significance of aberrant bile ducts. // Am. J. Surg. 1962.- vol. 104. – p. 14-19. (доп проток)
- Fujita N., Shirai Y., Ohtani T., Tsukada K., Hirota M., Hatakeyama K. Junction of the cystic duct with the left hepatic duct: report of a case discovered during laparoscopic cholecystectomy. // Surg. Laparosc. Endosc. 1996. – vol. 6.- p. 445-446. ( 3 тип мех поврежд)
- Gigot J.F. Bile duct injuriy during laparoscopic cholecystectomy: risk factors, mechanisms, type, severity and immediate detection. // Acta chir. Belg. 2003.- vol. 103.- p.154 – 160.
- Gigot J.F., Etienne J., Aerts R., Wibin E., Dallemagne B., Deweer F., Fortunati D., Legrand M., Vereecken L., Doumont J.M., Van Reepinghen Ph., Beguin Cl. The dramatic reality of biliary tract injury during laparoscopic cholecystectomy: an anonymous multicenter Belgian survey of 65 patients. // Surg. Endosc. 1997.- vol. 11. – p. 1171-1178.
- Goor D.A., Ebert P.A. Anomalies of the biliary tree. // Arch. Surg. 1972.- vol. 104.- p. 302-309
- Gross R.E. Congenital anomalies of the gallbladder. A review of 148 cases, with report of double gallbladder. // Arch. Surg. 1936.- vol. 32.- p. 131-162.
- Hawasli A. Does routine cystic duct cholangiogramm ouring laparoscopic cholecystectomy prevent common bile injury. // Surg. Laparosc. Endosc. 1993.- vol. 3.- p. 290-295.
- Healey J.E., Schroy P.S. Anatomy of the bile ducts within the human liver. // Arch. Surg. 1953.- vol. 66.- p. 599-616.
- Heloury Y., Leborgne J., Roger J.M., Robert R., Lehur P.A., Pannier M., Barbin J.Y. Radiological anatomy of the bile ducts based on intraoperative investigation in 250 cases. // Anat. Clin. 1985. – vol. 7. – p. 93-102.
- Hirono Y., Takita Y., Nitta N., Hashimoto H. Double cystic duct found by intraoperative cholangiography in laparoscopic cholecystectomy. // Surg. Laparosc. Endosc. 1997. – vol. 7.- p. 263-265.
- Hollinshead W.H. The thorax, abdomen and pelvis. // In: Anatomy for Surgeons. – vol. 2.-New York: Harper end Row Publishers, 1971, p. 346. (анатомия из молменти)
- John T.G. Anomalous biliary anatomy. // Am. J. Surg. 1996. – vol. 17. –p. 543- 549. (47%).
- Johnston E.V., Anson B.J. Variations in the formation and vascular relationshipof the bile ducts. // Surg. Gynecol. Obstet. 1952.-vol. 94.-p. 669-686. (ист пуз арт 13 ).
- Known A.H., Uetsuji S., Ogura T., Kamiyama Y. Spiral computed tomography scanning after intravenous infusion cholangiography for biliary duct anomalies. // Am. J. Surg. 1997.- vol. 174. – p. 396-401.
- Kullman E., Borch K., Lindstrom E., Svanvik J., Anderberg B. Value of routine intraoperative cholangiography in detecting aberrant bile ducts and bile duct injuries during laparoscopic cholecystectomy. // Br. J. Surg. 1996.- vol. 83.-p. 171-175. (до20% при радиоло имеют варианты анна ЖП)
- Lamah M. and Dickson G.H. Congenital anatomical abnormalities of the extrahepatic biliary duct: a personal audit. //Surg. Radiol. Anat. 1999.- vol 21.- p. 325-327. (огран возм ЛХЭ стр 14 текста).
- Lamah M., Karanjia N.D. Anatomical variations of the extrahepatic biliary tree: review of the world literature. Clin. Anat. 2001. –vol.14.- p. 167-172.
- Larobina M. and Nottle P. Extrahepatic biliary anatomy at laparoscopic cholecystectomy: is aberrant anatomy important? //ANZ. J. Surg., 2005. - v.75.- p. 392-395.
- Lee V.S., Chari R.S., Cucchiaro G, Meyers W.C. Controversies in LC: problem patients: complications of laparoscopic cholecystectomy. // Am. J. Surg. 1993.- vol. 165.- p. 527-532.) (неопытность хирурга).
- McMahon A.J., Fullarton G., Baxter J.N., O’Dwyer P.J. Bile duct laparoscopic cholecystectomy and bile leakage in laparoscopic cholecystectomy.//Br. J. Surg. 1995.- vol. 82.-h.307.*
- McWhorter G.L. A new method of gallbladder dissection with a consideration of the surgical anatomy. // Surg. Gynecol. Obstet. 1923.-vol. 36.-p. 256-263.
- Michels N.A. The hepetic, cystic and retroduodenal arteries and their relation to the biliary ducts. // Ann. Surg. 1951.- vol. 133. – p. 503-524. . (ист пуз арт 13 ).
- Michels N.A. Variotional anatomy of the hepatic, cystic, and retroduodenal arteries: a statistical analysis of their origin, distribution, and relations to the biliary ducts in two hundred bodies. // Arch. Surg. 1953. –vol. 66. –p. 20-34. (Cузуки (общая анатомия)
- Molmenti E.P., Pinto P.A., Klein A.S. Normal and variant arterial supply of the liver and gallbladder.// Pediatr. Transplantation, 2003. – vol. 7. – p. 80-82.
- Moosman D.A., Coller F.A. Prevention of traumatic injury to the bile ducts. //Am. J. Surg. 1951.-vol. 82.-p. 132-143.
- Moossa A.R., Easter D.W., Van Sonnenberg E., Casola G., D’Agostino H. Laparoscopic injuries to the bile duct : a cause of concern. // Ann. Surg. 1992. – vol. 215. –p. 203-208. (второй механиз повр из гигота
- Ng J.W., Yeung G.H., Lee W.M., Tse S. Isolated duplications of the cystic duct: case report and implications in laparoscopic cholecystectomy. // Surg. Laparosc. Endosc. 1996. – vol. 6.- p. 310-314.
- Orlando R., Russell J.S., Lynch J., Mattie A. Laparoscopic cholecystectomy: a statewide experience. // Arch. Surg. 1993.- vol. 128.- p. 494-499.
- Perelman H. Cystic duct duplication. // J. Amm. Med. Ass. 1961.- vol. 175.- p. 710-711.
- Ress A.M., Sarr M.G., Nagorney D.M., Farnell M.B., Dohohue J.H., McIlrath D.C. Spectrum and management major complications of laparoscopic cholecystectomy. // Am. J. Surg. 1993.- vol. 165. – p. 655-662. (второй механиз повр из гигота)
- Richardson M.S., Bell G., Fullarton M. Incidence and nature of bile duct injuries following laparoscopic cholecystectomy: on audit of 5913 cases.// Br. J. Surg. 1996.- vol. 83.-1356-1360.
- Rossi R.L., Schirmer W.J., Braasch J.W., Sanders L.B., Munson J.L. Laparoscopic bile duct injury : risk factors, recognition and repair. // Arch. Surg. 1992.- vol. 127.- p. 422- 427. (классич повр. ЖП).
- Scott-Conner C.E.H., Hall T.J. Variant arterial anatomy in laparoscopic cholecystectomy. // Am.J.Surg. 1992.-vol. 163.- p. 590-592. (дуга пПа)
- Shaw M.J., Dorsher P.J., Vennes J.A. Cystic duct anatomy: an endoscopic perspective. // Am. J. Gastroenterol. 1993.-vol. 88.-p.2102-2106. (норм соотн пуз пр и ОЖП 17-35%)
- Soper N.J., Flye M.W., Brunt L.M., Stockmann P.T., Sigard G.A., Picus D., Edmundowicz S.A., Aliperti G. Diagnosis and management of biliary complications of laparoscopic cholecystectomy. // Am. J. Surg. 1993.- vol. 165. – p. 663-669. (классич повр. ЖП).
- Sperling M.J. Absente of cystic duct. // Arch. Surg. 1965.- vol. 91. – p. 1078. (врож отсут пуз прот)
- Suzuki M., Akaishi S., Rikiyama T., Naitoh T., Rahman M.M., Matsuno S. Laparoscopic cholecistectomy, Calot’s triangle, and variations in cystic arterial supply. // Surg. Endosc. 2000.- vol. 14.- p. 141-144.
- The Southern Surgeons Club. A prospective analysis of 1518 laparoscopic cholecystectomies. // New Engl. Med. 1991.- vol. 324.-p. 1073-1078.*
- The Southern Surgeons Club. Moore M.J., Bennett C.L. The learning curve for laparoscopic cholecystectomy. // Am.J.Surg. 1995.- vol. 170. – p. 55-59.
- Toker P. Anatomy in surgery, 3rd end. New York: Springer-Verlag, 1985.- 539 p.
