Поражение бедренных артерий является наиболее часто встречающейся локализацией атеросклеротического поражения артерий нижних конечностей. При обследовании популяции населения старше 50 лет, ее частота составляет 1%, а у больных с периферическим атеросклерозом 55%. [1].
Клинически поражение этой зоны протекает доброкачественно, около 78% пациентов с перемежающейся хромотой при проведении только консервативной терапии составляют стабильную группу в течение 6-ти лет [2]. Инвалидизирующая перемежающаяся хромота и критическая ишемия являются показанием к оперативному лечению – хирургической (реконструктивная сосудистая операция или ангиопластика) реваскуляризации, при этом операцией выбора до настоящего времени считается шунтирование.
Чрескожная транслюминальная ангиопластика (ЧТА) уже почти 40 лет интенсивно внедряется в лечение окклюзирующих поражений бедренных артерий. Возможность реканализации длинных окклюзий, хорошие непосредственные результаты, простота процедуры, очень низкий процент осложнений постепенно расширяют показания к ЧТА и в настоящее время она проводится даже у пациентов с выраженными и распространенными поражениями периферических артерий.
Несмотря на совершенствование методики и инструментария, широкое внедрение стентирования и энтузиазм исследователей, отдаленные результаты ангиопластики в 90-е годы не соответствовали результатам реконструктивных операций.
Клинические серии исследований показывали проходимость участка ангиопластики в течение 2-х лет в пределах от 46 до 79% и 36 - 45% в течение 5-ти лет [3-8]. Подобные результаты не позволяли широко рекомендовать внедрение ЧТА в бедренно-подколенном сегменте [8-10].
Эти данные значительно отличаются от результатов операций в аорто-подвздошной зоне, в которой роль ангиопластики достоверно выше и отдаленные результаты не отличаются от результатов реконструктивной хирургии [10-11].
Тем не менее, продолжаются исследования с многофакторным анализом, в каких случаях ЧТА предпочтительнее реконструктивной хирургии и какие причины влияют на отдаленные результаты. В данной работе мы анализируем наш опыт ангиопластики окклюзированных (длиной более 10 см) бедренных артерий.
Материалы и методы.
С 1993 года по 2002 год, мы произвели 73 эндоваскулярных реканализации окклюзированных поверхностных бедренных артерий (ПБА) у 58 пациентов (56 мужчин и 2 женщины). Длина поражения более 10 см (от 11 до 26 см, средняя длина 15.5 см). В 8 случаях у 7 больных были полностью окклюзированные ПБА от устья до входа в Гунтеров канал.
Анамнез заболевания до 10 лет. Возраст колебался от 52 до 80 лет (средний возраст составил 61.5 ± 9.8 лет). Курильщики - 28 пациентов (48.3%), артериальная гипертензия отмечена у 30 (51.7%), гиперхолестеринемия у 24 (41.4%) и диабет у 13 (22.4%). У 27 (46.6%) отмечена ишемическая болезнь сердца. Показания к малоинвазивному вмешательству определялись по результатам неинвазивных процедур и ангиографии.
Клиническая симптоматика. В 42 конечностях выявлена только перемежающаяся хромота (57.5%), в 10 - боли в покое (13.7%), ишемические язвы и некрозы - в 18 случаях (24.7%) и острая ишемия в 3 (4.1%).
У пациентов с перемежающейся хромотой средний плече-лодыжечный индекс (ПЛИ) до операции составил 0.61 (± 0.11), а у пациентов с критической ишемией - 0.39 (± 0.12).
Следует отметить, что относительно часто проводились сочетанные вмешательства: с ангиопластикой подколенно-тибиального сегмента, которые проведены у 9 больных (14.3%), и особенно аорто-подвздошного сегмента - у 17 пациентов (25.4%). Таким образом, обеспечивалось хорошее функционирование «путей притока» и «путей оттока», что, в частности, предопределяло благоприятные отдаленные результаты ангиопластики.
Техника оперативного вмешательства.
Реканализация артерии производилась с помощью гидрофильного проводника "Road Runner" (COOK) и была успешной в 73 (92,4%) случаях из 79. Использовались доступы: антеградный бедренный в 65 случаях и ретроградный подколенный в 8. При наличии культи ПБА (проксимальной) - реканализация окклюзированного сегмента производилась антеградно, а при отсутствии культи – ретроградно, через подколенную артерию. Следует отметить, что именно отсутствие культи ПБА и наличие мощной коллатерали, отходящей в месте окклюзии, являлось основной причиной неудач при попытке антеградной реканализации.
После проводниковой реканализации выполнялась баллонная ангиопластика, использовались баллонные катетеры "Opta" (Cordis), диаметр баллона 5, 6 и 7 mm, длинной 100 мм.
Имплантировано 195 стентов, использовались ZA–стенты фирмы "COOK" (индекс стентирования – 2.67), длиной 40, 60 и 80 мм, диаметром 6 - 8 мм. Стентирование производили «точечно» в зонах остаточного стеноза или окклюзирующей диссекции.
Самое большое количество стентов, имплантированных в одной ПБА - 4.
Анестезиологическое пособие. Во всех случаях использовалась местная анестезия.
Медикаментозное обеспечение: симптоматическое лечение + плавикс 1 таблетка 1 раз в день за 3-4 дня до вмешательства, во время операции - гепарин 100 МЕ на 1 кг веса пациента, после - гепарин 1000 МЕ в час с уменьшением дозы и с постепенным переходом на третьи сутки (перед выпиской) на низкомолекулярный гепарин – фраксипарин 0,6 1 раз в день в течение 2 недель + плавикс в течение 6 месяцев + аспирин кардио 100 мг постоянно + симптоматическое лечение.
Срок госпитализации составил в среднем 2.56 дня (от 2-х до 4-х суток).
Результаты.
Непосредственные результаты:После удачной проводниковой реканализации с последующей баллонной дилятацией и стентированием хорошие ангиографические и клинические результаты были достигнуты во всех случаях. Осложнения отмечены у 4 больных (6.0%). В 2 случаях произошла дистальная артериальная эмболия, в 2 других образовалась ложная аневризма бедренной артерии. Периферическая макроэмболия с перекрытием кровотока подколенной артерии или магистральных артерий голени – одно из основных осложнений реканализации хронических окклюзий. В одном случае эмбол удалось аспирировать через катетер, в другом случае – эмбол был низведен в переднюю тибиальную артерию и произведена открытая эмболэктомия типичным доступом на уровне лодыжки. Ложные аневризмы были пролечены с помощью давящей повязки, контролируемой ультразвуком.
Ближайшие и отдаленные результаты: Результаты оценивались по первичной и вторичной проходимости оперированных артерий
Контроль осуществляли с помощью клинического осмотра с использованием неинвазивных методов исследования (измерение ПЛИ и ультразвуковое дуплексное сканирование) в сроки 3, 6, 12 месяц и затем ежегодно.
Клинический успех определялся в случае улучшения клинической симптоматики и увеличения плече-лодыжечного индекса не менее чем на 0.15 иили нормализации периферического пульса. Средний ПЛИ увеличился до 0.86 ± 0.22(p < 0.01) при исходной перемежающейся хромоте, а при критической ишемии до 0.78 ± 0.14 (p < 0.01).
В отдаленном периоде (36 месяцев и более) прослежен 31 больной, у которых ранее проведены 38 реканализаций. Рестенозы более 50% выявлены в 11 артериях (28.9%), реокклюзии в 7 (18.4%). Всем больным повторно производилась ангиопластика. Лишь у одного пациента, в связи с невозможностью повторной реканализации выполнено бедренно-подколенное шунтирование. 3 больным произведены повторные ангиопластики в срок наблюдения до 96 месяцев по 3 раза, а одному – 4 раза с сохранением проходимой ПБА. Следует отметить, что при наличии исходной проходимости проксимальной порции подколенной артерии отмечены наилучшие результаты как в ближайшем, так и отдаленном периоде. Рестеноз чаще возникал в дистальной порции ПБА (в Гунтеровом канале), нежели в проксимальных порциях. При этом возникновение реокклюзии поверхностной бедренной артерии протекало без выраженной клинической симптоматики, характерной для острой окклюзии. Первичная проходимость после ангиопластики составила 76% через 5 лет, вторичная 84,5%. Осложнения: у 1 больного с повторными пункциями через подколенную артерию возникло артерио-венозное соустье. Соустье было разобщено хирургически. Летальных случаев не отмечено. Ампутаций нижних конечностей не проводилось. Клинически улучшение кровообращения в нижних конечностях и, соответственно, повышение качества жизни больного отмечалось во всех случаях.
Кумулятивная проходимость рассчитывалась с использованием метода Kaplan-Meier и сравнивалась с log-rank тестом (см. рис. 1)
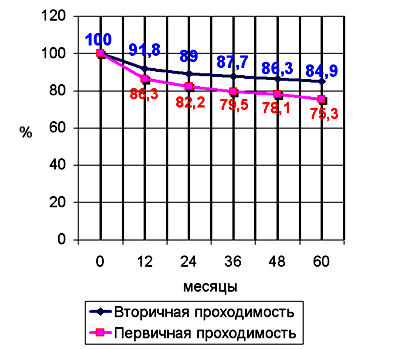
Рис. 1. Кумулятивная первичная и вторичная проходимость ЧТА поверхностной бедренной артерии
В качестве примера приводим следующее клиническое наблюдение:
Пациент Г., 51 год, с жалобами на перемежающуюся хромоту с обеих сторон через 150м. Анамнез заболевания около 10 лет, когда впервые отметил боли в икроножных мышцах при ходьбе. При поступлении обе нижние конечности теплые, обычной окраски, движения и чувствительность не снижены, икроножные мышцы безболезненные при пальпации. Пульсация определяется только на уровне бедренных артерий, дистальнее отсутствует, 2Б степени ишемии. ПЛИ с обеих сторон 0,56.
При ангиографии выявлено: субтотальный стеноз правой общей подвздошной артерии (ОПА) в дистальном отделе, бифуркационный стеноз правой общей бедренной (ОБА) артерии 70%, окклюзия правой ПБА в Гунтеровом канале длиной 4 см, окклюзия левой ПБА от устья до подколенной артерии, подколенные артерии и артерии голени проходимы, без гемодинамически значимых сужений. (см. рис. 2)
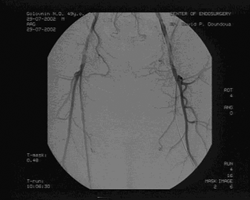
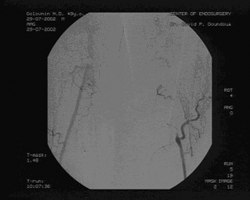
Рис. 2. Результаты до операционного ангиографического исследования.
Пациенту произведена баллонная ангиопластика и стентирование правой ОПА и ОБА, реканализация обеих ПБА с последующей баллонной ангиопластикой и стентированием через подколенные пункционные доступы с обеих сторон. Баллонная ангиопластика ОПА и ОБА проводилась баллонами диаметром 10 и 7мм с последующим стентированием, диаметр и длина стентов 10 мм и 60 мм в ОПА, 8 мм и 40 мм в ОБА, соответственно. Реканализация ПБА проведена с обеих сторон гидрофильным проводником "Road Runner" с последующей баллонной ангиопластикой баллонами диаметром 6 и 7 мм и стентированием. Во всех артериях установлены ZA-стенты соответствующего диаметра и длиной от 40 до 80 мм. Всего установлено 6 стентов: в правую ОПА, правую ОБА, правую ПБА, 3 стента в левую ПБА: 1 в проксимальной части, начиная от устья , 2 в зоне Гунтерова канала. (см. рис. 3)
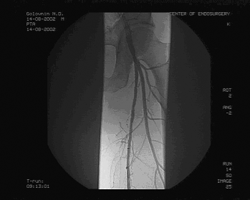
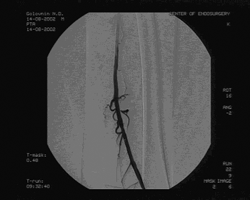
Рис. 3. Контрольная ангиография после реканализации и стентирования левой ПБА.
После операции отмечалась отчетливая пульсация артерий нижних конечностей на всех уровнях, пациент выписан на 2 сутки после ангиопластики.
Через 6 месяцев пациент отметил появление чувства онемения левой стопы при ходьбе. Выполнено дуплексное сканирование артерий нижних конечностей, которое выявило стеноз левой ПБА 80% до входа в Гунтеров канал. ПЛИ слева 0,7. При ангиографии выявлен стеноз левой ПБА на границе средней и нижней трети тотчас выше установленных ранее стентов, в других артериях и ранее стентированных участках изменений нет. Подколенным доступом произведена баллонная дилятация с постановкой ещё одного стента проксимальнее предыдущего в левую ПБА. Пациент выписан на 2е сутки, кровоток в левой нижней конечности полностью восстановлен, ПЛИ 0,86.
Пациент обратился вновь в клинику через 1,5 года после первичной ангиопластики и через год после повторной с перемежающейся хромотой слева через 400м, правая нк не беспокоила. Пациент также обратил внимание на умеренный отек левой стопы. ЛПИ слева составил 0,64. Вновь проведена ангиография, на этот раз трансрадиальным доступом, выявлены рестенозы внутри стентов в устье левой ПБА, рестеноз в средней порции левой ПБА, где стентирование не проводилось, рестеноз внутри проксимального стента в Гунтеровом канале. Правая нижняя конечность оставалась без гемодинамически значимых изменений. Обнаружен артериовенозный сброс в левой нижней конечности из подколенной артерии в одноименную вену. (см. рис. 4а и 4б)
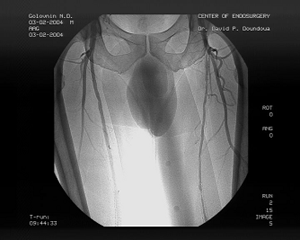 |
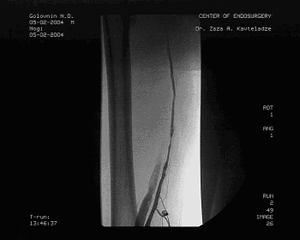 |
|
| Рис. 4а Контрольная ангиография через 18 мес. Радиальный доступ. | Рис. 4б Дооперационная ангиография через 18 месяцев с артерио-венозным сбросом. Доступ через подколенную артерию |
Доступом в подколенной области выделена подколенная артерия слева, перевязано артериовенозное соустье, пунктирована подколенная артерия и произведена баллонная ангиопластика стенозов левой ПБА с хорошим непосредственным результатом, не потребовавшая дополнительного стентирования. (см. рис. 5)
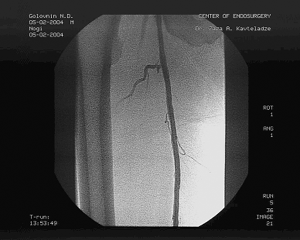
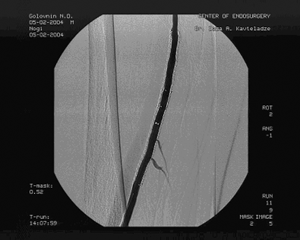
Рис. 5. Контрольная ангиография после ЧТА левой ПБА.
Пациент выписан на 4-e сутки с клиническим выздоровлением и повышением ПЛИ до 0,89.
Данное клиническое наблюдение интересно тем, что пациенту произведена многоэтажная множественная ангиопластика окклюзированных магистральных артерий нижних конечностей. После повторной пункции подколенной артерии образовалось артерио-венозное соустье, потребовавшее хирургической ликвидации. В общей сложности имплантировано 7 стентов. Несмотря на неоднократные вмешательства сохраняется проходимость всех нативных магистральных артерий нижних конечностей, госпитализации короткие, операции щадящие, малоинвазивные. При этом в будущем остается возможность использования любого метода для лечения.
Дискуссия.
Сообщений об использовании метода ЧТА при лечении окклюзирующих поражений ПБА огромное количество, при этом авторы приводят очень сильно различающиеся данные, как о клинических и ангиографических показаниях для использования метода, так и об отдаленных результатах вмешательств. Что касается техники операции (способов и механизма реканализации, выбора доступа для вмешательства, выбора инструментов и стентов), она в принципе хорошо отработана. Факторов, воздействующих на отдаленные результаты ЧТА несколько, однако наиболее важными следует считать ангиографические критерии, поскольку именно они определяют проходимость артерии в отдаленном периоде. ([5],[6],[12],[13]) Длина поражения, его локализация, состояние "путей оттока" - вот основные критерии, обеспечивающие успех или приводящие к неудовлетворительному результату. До настоящего времени считалось, что лишь при стенотических поражениях ПБА и коротких, менее 5 см, окклюзиях с сохраненным дистальным артериальным руслом может быть успешно применена ЧТА, а в остальных случаях пациенту показана стандартная шунтирующая операция (например, G.Agrifiglio с соавторами, 1999). В подтверждение этого факта, неудовлетворительные результаты описываются как раз при ЧТА бедренно-подколенной зоны при длинных поражениях ([17], [6]). Кроме того, проходимость зависит от зоны поражения: чем дистальнее произведено вмешательство, тем хуже его результаты.
Дискутабельным остается вопрос о стентировании при ЧТА. Резидуальные стенозы после ангиопластики (диссекции, отслойки интимы, эластические стенозы) являются показанием для стентирования в бедренно-подколенной зоне. Однако при исследовании, проведенном Bergeron с соавторами показано, что стенты вызывают неоинтимальную гиперплазию уже через 4 месяца после имплантации [11]. Другие несколько исследований отдаленных результатов стентирования в этой зоне описывают возникновение рестенозов от 20 до 40% случаев в сроки от 6 до 24 месяцев, вне зависимости от используемой модели стента [11]. В этих исследованиях авторы пытаются определить причину столь высокой частоты рестенозов, считая одной из них стентирование при окклюзиях. Так при стентировании реканализованного сегмента артерии рестенозы возникают в 33-40%, в то время как стентирование стенозов лишь в 9-18%, второй причиной выделяется зона стентирования в ПБА. В нижней трети бедра рестенозы возникают в 40% случаев, а в верхней трети ПБА лишь в 9%. Количество имплантированных стентов, то есть длина участка артерии, покрытого стентами, тоже влияет на частоту возникновения рестенозов: 1 стент - 3,6% рестенозов в течение 6 месяцев и 18% - в течение 4 лет, а при 2 стентах и более соответственно 7,9% и 34% (25). Стентирование, по мнению большинства исследователей, не улучшает отдаленные результаты в бедренно-подколенной зоне, поскольку увеличивает частоту рестенозов. Предпринятая попытка использования нитиноловых стентов "Smart" (Cordis), покрытых сиролимусом при ангиопластике ПБА, показала лучшие результаты по первичной проходимости по сравнению контрольной группой в сроки 6 мес. Но затем в сроки 12 месяцев результаты практически сравнялись [29].
Заключение.
Основываясь на нашем опыте, мы считаем, что "точечное" (при остаточном стенозе и окклюзирующей диссекции) стентирование является методом, позволяющим получить удовлетворительные результаты ангиопластики окклюзированной ПБА, предотвращая острый тромбоз и ранние реокклюзии в оперированной артерии.
Мы считаем, что улучшение результатов ЧТА возможно только за счет агрессивных реинтервенций. Только реинтервенции приводят к улучшению отдаленных результатов и проходимости стентированного сегмента. Такого же мнения придерживаются и другие исследователи ([11], [24], [27]).
Как много и как часто возможно проведение ЧТА для устранения рестенозов? Как показывает наш опыт, ЧТА возможно проводить бесконечное количество раз в ранее реканализованной артерии с постановкой дополнительных стентов или без них. Нужно ли бояться рестенозов и является ли это причиной отказа от попыток ЧТА длинных окклюзий ПБА? - нет. Что приобретает пациент, выбирая ЧТА, а не шунтирование? Во-первых, минимальные сроки госпитализации, позволяющие не отрываться надолго от повседневной занятости, минимальное количество осложнений и быстрая реабилитация в послеоперационном периоде из-за минимальной операционной травмы. Возможность выполнения многоэтажных многососудистых вмешательств для улучшения "путей притока" и "путей оттока", позволяющих полностью, за одну госпитализацию восстановить кровоток в пораженной конечности или даже в обеих конечностях.
При развитии рестеноза в стентированной артерии всегда есть возможность проведения неоднократных повторных ЧТА, что приводит к полному восстановлению кровотока. Необходимо периодические осмотри ангиохирурга и УЗДС-контроль за стентированной артерией, а также постоянная антикоагулянтная и дезагрегационная терапия после вмешательства. Да, реканализованная и стентированная артерия требует внимания и ухода со стороны пациента и его лечащего врача, но так ли это отличается от тактики ведения больных после открытых реконструктивных операций? Однако в случае с ЧТА мы сохраняем нативную артерию и всегда оставляем пациенту возможность проведения повторных вмешательств при "катастрофе" в оперированной артерии, что крайне сложно, а в большинстве случаев невозможно при открытых реконструктивных операциях. Единственный большой недостаток ЧТА при реканализации длинных окклюзии (более 10 см) ПБА - высокая стоимость процедуры, но это компенсируется выше приведенными бесспорными достоинствами.
Высокая вторичная проходимость при стентировании непосредственно связана с обязательным периодичным неинвазивным дуплексным обследованием зоны ангиопластики для как можно более раннего выявления неоинтимальной гиперплазии и борьбы с ней.
Анализируя результаты исследования и данные литературы, мы считаем, что ЧТА является методом выбора при лечении окклюзий в бедренной зоне.
Выбор способа реваскуляризации при поражениях ПБА основывается на анализе общего состояния пациента (с учетом возраста, сопутствующей патологии); данных инструментальных методов исследования (протяженности и степени поражения и состоянии дистального артериального русла), а также степени ишемии, наличии трофических нарушений, инфекции.
Больным старческого возраста, имеющим тяжелую сопутствующую патологию – сахарный диабет, ИБС и другие заболевания, с локальным или распространенным поражением ПБА показано выполнение ангиопластики.
Применение ангиопластики и стентирования длинных окклюзии ПБА позволяет достичь удовлетворительных результатов в большинстве случаев, как непосредственно после операции, так и в отдаленном периоде, сопоставимых, а в ряде случаев превосходящих стандартные операции шунтирования.
Литература
- DORMANDY JA, MAHIR MS.The natural history of peripheral atheromatous disease of legs. In: Greenhalgh RM, Jamieson CW, Nicolaides AN, (ed.), Vascular surgery. Issues in current practice.London, Grune & Stratton, 1986 pp 3-17.
- MARTY-ANE C, ALAUZEN M, MARY H.L’expectative medicale dans les lesions obstructives isolees de l’art e re femorale superficielle. In: B r a n c h e reau A, JausseranJM, (eds), Traitement des lesions obstructives de l’artere femorale superficielle. Marseille, CVN, 1992 pp 13-17.
- JOFFRE F, ROUSSEAU H, MEITES G, CHEMALI R.Resultats a long terme des angioplasties femoro-poplitees. In: Branchereau A, Jausseran JM, (eds), Traitement des lesions obtructives de l’artere femorale superficielle.Marseille, CVN, 1992 pp 39-51.
- JOHNSTON KW.Femoral and popliteal arteries: reanalysis of results of balloon angioplasty. Radiology 1992; 183: 767-771.
- HUNINK MGM, DONALDSON MC, MEYEROVITZ MF et al.Risks and benefits of femoropopliteal percutaneous balloon angioplasty. J Vasc Surg 1993; 17: 183-194.
- BECQUEMIN J-P, CAVILLON A, HAIDUC F.Surgical transluminal femoropopliteal angioplasty: multivariate analysis outcome.J Vasc Surg 1994; 19: 495-502.
- MATSI PJ, MANNINEN HI.Impact of different patency criteria on long-term results of femoropopliteal angioplasty: analysis of 106 consecutive patients with claudication. J Vasc Interv Radiol 1995; 6: 159-163.
- STANLEY B, TEAGUE B, RAPTIS S et al.Efficacy of balloon angioplasty of the superficial femoral artery and popliteal artery in the relief of leg ischemia. J Vasc Surg 1996; 23: 679-685.
- COURBIER R.Le traitement des lesions de l’artere femorale superficielle. In: Branchereau A, Jausseran JM, (eds), Traitement des lesions obtructives de l’artere femorale superficielle. Marseille, CVN, 1992 pp XIII-XIV.
- DIETHRICH EB, PAPAZOGLOU K.Endoluminal grafting for aneurysmal and occlusive disease in the superficial femoral artery: early experience. J Endovasc Surg 1995; 2: 225-239.
- BERGERON P, PINOT JJ, POYEN V et al.Long-term results with the Palmaz stent in the superficial femoral artery. J Endovasc Surg 1995; 2: 161-167.
- AHN SS, RUTHERFORD RB, BECKER GJ et al.Reporting standards for lower extremity arterial endovascular procedures. J Vasc Surg 1993; 17: 1103 -1107.
- BRAY AE, LIU WG, LEWIS WA et al.Strecker stents in the femoropopliteal arteries: value of Duplex ultrasonography in restenosis assessment. J Endovasc Surg 1995; 2: 150-160.
- BECKER GJ, KATZEN BT, DAKE MD.Noncoronary angioplasty. Radiology 1989; 170: 921-940.
- MATSI PJ, MANNINEN HI, VANNINEN RL et al.Femoropopliteal angioplasty in patients with claudication: primary and secondary patency in 140 limbs with 1-3 year follow-up. Radiology 1994; 191: 727733.
- Guidelines for percutaneous transluminal angioplasty.Standards of Practice Committee of the Society for Cardiovascular and Interventional Radiology. Radiology 1990; 177: 619-626.
- MURRAY RR Jr, HEWES RC, WHITE RI Jr et al.Long-segment femoropopliteal stenoses: is angioplasty a boom or a bust ? Radiology 1987; 162: 473-476.
- CURRIE IC, WAKELEY CJ, COLE SE et al.Femoropopliteal angioplasty for severe limb ischaemia. Br J Surg 1994; 81: 191-193.
- SIVANANTHAN UM, BROWNE TF, THORLEY PJ, REES MRPercutaneous transluminal angioplasty of the tibial arteries. Br J Surg 1994; 81: 1282-1285.
- BLAIR JM, GEWERTS BL, MOOSA Hetal.Percutaneous transluminal angioplasty versus surgery for limb-threatening ischemia. J Vasc Surg 1989; 9: 698-703.
- SEEGER JM.Laser angioplasty. A vascular surgeon’s view. Circulation 1991; 83 (I): 97-98.
- SATIANI B, DAS BM, VACCARO PS, GAWRON D.Angiographic follow-up after laser-assisted balloon angioplasty. J Vasc Surg 1993; 17: 960-966.
- FISHER CM, FLETCHER JP, MAY Jetal.No additional benefit from laser in balloon angioplasty of the superficial femoral arter y. Eur J Vasc Endovasc Surg 1996; 11: 349-352.
- DALSING MC, HARRIS VF.Intravascular Stent. In: White RA, Fogarty TJ, (eds), Peripheral endovascular interventions. St Louis, Mosby, 1996 pp 315-339.
- HENRY M, AMOR M, HENRY I et al.Placement of Palmaz stent in femoropopliteal art e r i e s: a six year experience. Factors influencing restenosis and longterm results. In: Abstract Book 6° International course on peripheral vascular intervention. Oct 1995, Nancy, France.
- WHITE GH, LIEW SCC, WAUGH RC et al.Early outcome and intermediate follow-up of vascular stents in the femoral and popliteal arteries without long-term anticoagulation. J Vasc Surg 1995; 21: 270-281.
- DO-DAI-DO, TRILLER J, WALPOTH BH et al.A comparison study of self-expandable stents vs balloon angioplasty alone in femoropopliteal artery occlusions. Cardiovasc Intervent Radiol 1992; 15: 306-312.
- HENRY M, AMOR M, HENRY I et al.Endoluminal bypass grafting in leg arteries with the Cragg Endopro System 1. A series of 105 patients. In Abstract book 6° International course on peripheral vascular intervention. Oct 1995, Nancy, France.
- G.Agrifiglio с соавт.1999